Классификация химических реакций.
02.07.01.01. Реакцией соединения является:
а) AgNO3 + HCl = AgCl + HNO3;
б) O2 + 4NO2 + 2H2O = 4HNO3;
в) CaCO3 = CaO + CO2;
г) Fe + CuSO4 = FeSO4 + Cu.
02.07.01.02. Реакцией обмена является:
а) О2 + 4NO2 + 2H2O = 4HNO3;
б) Fe + CuSO4 = FeSO4 + Cu;
в) AgNO3 + HCl = AgCl + HNO3;
г) 2KMnO4 = K2MnO4 + MnO2 + O2.
02.07.01.03. Реакция ионного обмена протекает между:
а) оксидом углерода и оксидом кальция,
б) сероводородом и кислородом,
в) соляной кислотой и аммиаком.
г) хлоридом калия и нитратом серебра
02.07.01.04. При взаимодействии растворов гидроксида кальция и карбоната натрия можно получить:
а) карбонат кальция, углекислый газ и воду;
б) гидроксид натрия, углекислый газ и воду;
в) карбонат кальция и гидроксид натрия
г) гидрокарбонат натрия и гидрокарбонат кальция
02.07.01.05. Реакция натрия с водой относится к реакциям:
а) соединения;
б) замещения;
в) разложения;
г) обмена.
02.07.01.06. Горящая свеча гаснет в закрытой пробкой банке, потому что:
а) повышается содержание азота;
б) образуется водяной пар, гасящий пламя;
в) повышается температура.
г) не хватает кислорода
д)
02.07.01.07. Укажите реакцию разложения
а) H2O + SO2 =H2SO3
б) 2H2O=2H2+O2
в) Fe + 2HCl=FeCl2+H2
г) Fe + CuSO4 = FeSO4 + Cu.
02.07.01.08. Окислительно восстановительная реакция
а) H2SO4+BaCl2=BaSO4+2HCl
б) Zn+ H2SO4=ZnSO4+H2
в) CaO+CO2=CaCO3
г) NaOH+HCl=NaCl+H2O
Скорость химической реакции.
02.07.02.01. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Температурный коэффициент реакции равен:
а) 4
б) 8
в) 2
г) 3
02.07.02.02. Фактор, не влияющий на скорость химической реакции:
а) давление.
б) катализатор.
в) концентрации реагирующих веществ.
г) форма сосуда, в котором протекает реакция.
02.07.02.03. При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
а) в 2 раза
б) в 8 раз
в) в 4 раза.
г) в 16 раз.
02.07.02.04. Максимальная скорость химической реакции будет при взаимодействии веществ, формулы которых:
а) Zn (гран.) и НС1.
б) РЬ и НС1.
в) Zn (пыль) и НС1.
г) Fe и НС1.
Химическое равновесие.
02.07.03.01. Скорость прямой реакции N2 + O2 = 2NO - 180кДж возрастает , если
а) уменьшить концентрацию азота;
б) увеличить конценпрацию оксида азота (II);
в) понизить температуру.
г) увеличить концентрацыю кислорода
02.07.03.02. Реакция, химического равновесие которой сместиться в сторону образования исходных веществ, как при повышении температуры, так и при понижении давления:
а) 
 N2(г) + O2(г) 2NO(г) - Q
N2(г) + O2(г) 2NO(г) - Q
б) 
 2NO(г) + SO3(г) NO2(г) + SO2(г) - Q
2NO(г) + SO3(г) NO2(г) + SO2(г) - Q
в) 
 2NO(г) + SO2(г) N2O(г) + SO3(г) + Q
2NO(г) + SO2(г) N2O(г) + SO3(г) + Q
г) 
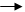 3Fe2O3(т) + H2(г) 2Fe3O4(т) + H2O(г) + Q
3Fe2O3(т) + H2(г) 2Fe3O4(т) + H2O(г) + Q
02.07.03.03. Фактор, влияющий на смещение химического равновесия:
а) вид химической связи.
б) катализатор.
в) природа реагирующих веществ.
г) температура.
02.07.03.04. С увеличениемконцентрации азота химическое равновесие сместится в уравнении химической реакции N2 + О2 ↔ 2NO:
а) в сторону образования продуктов реакции.
б) в сторону исходных веществ.
в) не изменится
02.07.03.05. С увеличением давления химическое равновесие сместится в уравнении химической реакции 2NO + О2 ↔ 2NO2:
а) в сторону образования продуктов реакции.
б) в сторону исходных веществ.
в) не изменится
02.07.03.06. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(Г) + Н2О(Г) ↔ С2Н5ОН(Г):
а) сместится в сторону образования продуктов реакции.
б) сместится в сторону исходных веществ.
в) не изменится
г)
02.07.03.07. Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + О2 ↔ 2SO3 + Q, в сторону исходных веществ необходимо:
а) увеличить давление.
б) повысить температуру.
в) понизить температуру.
г) применить катализатор.
02.07.03.08. Повышение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
а) 2Н2 + О2↔2Н2О + Q.
б) SO2 + Н2О↔H2SO3 + Q.
в) 2NO + О2↔2NO2 + Q.
г) C4H10↔C4H8 + H2 - Q.
02.07.03.09. Химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔ C2H6 + Q, при повышения давления:
а) сместится в сторону образования продуктов реакции.
б) сместится в сторону исходных веществ.
в) не изменится
02.07.03.10. Химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔ C2H6 + Q, при уменьшения температуры:
а) сместится в сторону образования продуктов реакции.
б) сместится в сторону исходных веществ.
в) не изменится
02.07.03.11. Химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔ C2H6 + Q, при увеличения концентрации С2Н4:
а) сместится в сторону продуктов реакции.
б) сместится в сторону исходных веществ.
в) не изменится
02.07.03.12. Химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔ C2H6 + Q, при применения катализатора:
а) сместится в сторону продуктов реакции.
б) сместится в сторону исходных веществ.
в) не изменится
