Конформационная изомерия этана
Предельные углеводороды
К предельным углеводородам (алканам (парафинам)) относятся соединения с открытой цепью, в которых атомы углерода соединены друг с другом простыми (одинарными) связями, а остальные свободные их валентности насыщены атомами водорода. В обычных условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный.
Члены гомологического ряда предельных углеводородов отвечают общей формуле CnH2n+2. Простейшим представителем насыщенных углеводородов является метан, структурная формула которого:
| H I H–C–H I H |
Строение молекулы метана
Приведенная структурная формула метана не отражает пространственного строения молекулы. Для рассмотрения этого строения необходимо вспомнить о формах электронных облаков и электронном строении атома углерода. Электронное строение атома углерода изображается следующим образом: 1s22s22p2 или схематически
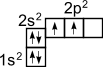
Как видно, на внешней оболочке имеются два неспаренных электрона, следовательно, углерод должен быть двухвалентен. Однако в подавляющем большинстве случаев углерод в органических соединениях четырехвалентен. Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. Схематически:
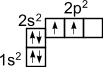 ––®
––® 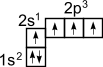
В результате имеется уже не два, а четыре неспаренных электрона. Поскольку эти четыре электрона различны (2s- и 2p- электроны), то должны бы быть различны и связи у атома углерода, однако однозначно показано, что связи в молекуле метана равнозначны. Оказывается при "смешении" четырех орбиталей возбужденного атома углерода (одной 2s- и трех 2p- орбиталей) образуются четыре равноценные sp3- гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Вследствие взаимного отталкивания sp3- гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109°28' (наиболее выгодное расположение).
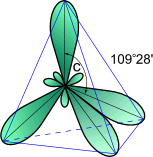
Рис.1 Модель sp3- гибридного состояния электронной оболочки атома углерода.
sp3- Гибридизация характерна для атомов углерода в насыщенных углеводородах (алканах) – в частности, в метане.
Рис.2 Схема электронного строения молекулы метана
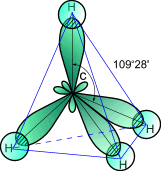
Из рис.2 видно, что каждая sp3- гибридная орбиталь при перекрывании с s- орбиталью атомов водорода образует с ними четыре, так называемые, s- связи. s- Связь – это одинарная ковалентная связь, образованная при перекрывании орбиталей по прямой, соединяющей ядра атомов, с максимумом перекрывания на этой прямой. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах, все валентные углы между направлениями связей равны между собой и составляют угол 109°28'. Следует отметить, что в молекуле этана (CH3–CH3) одна из семи s- связей (С–С) образуется в результате перекрывания двух sp3- гибридных орбиталей атомов углерода.
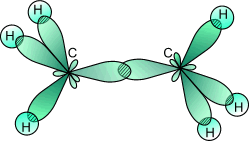
Рис. 3. Образование молекулы этана перерекрыванием двух гибридных электронных облаков атомов углерода.
Изомерия
Первые три члена гомологического ряда алканов – метан, этан, пропан – не имеют изомеров. Четвертый член – бутан C4H10 отличается тем, что имеет два изомера: нормальный бутан с неразветвленной углеродной цепью и изобутан с разветвленной цепью.
CH3–CH2–CH2–CH3(нормальный бутан)
| CH3 I CH3–CH–CH3(изобутан) |
Вид изомерии, при которой вещества отличаются друг от друга порядком связи атомов в молекуле, называется структурной изомерией или изомерией углеродного скелета.
Число изомеров возрастает с увеличением в молекуле углеводорода числа углеродных атомов. Так, у пентана их 3, у гексана - 5, у гептана - 9, у октана - 18, нонана - 35, а у декана C10H22 – уже 75.
Для изучения структурной изомерии необходимо просмотреть анимационный фильм "Структурная изомерия гексана" (данный материал доступен только на CD-ROM).
Углеводородные цепи молекул алканов могут вращаться вокруг простых связей, принимать различные геометрические формы и переходить друг в друга. Различные геометрические формы молекул, переходящие друг в друга путем поворота вокруг C–C связей, называются конформациями или поворотными изомерами (конформерами), а данный вид изомерии – конформационной (поворотной) изомерией.
Для изучения материала по названному виду изомерии необходимо просмотреть анимационные фильмы "Конформационная изомерия этана" и "Конформационная изомерия бутана" (данный материал доступен только на CD-ROM). Обращаем внимание на то, что тексты, сопровождающие эти фильмы, в полном объеме перенесены в данный подраздел и ниже следуют.
Конформационная изомерия этана
“Поскольку атомы углерода, связанные одинарной, так называемой, s(сигма)- связью, могут свободно вращаться друг относительно друга, "для молекулы этана возможно бесконечное число различных расположений атомов водорода в пространстве. Эти незакрепленные, постоянно меняющиеся расположения атомов в пространстве, называются конформациями.
Конформации отличаются потенциальной энергией, т. к. атомы водорода и связи C–Н отталкиваются друг от друга тем сильнее, чем ближе друг к другу они находятся. Из бесконечного числа конформаций этана можно выделить две предельные: обладающую максимальной энергией, когда атомы водорода при разных атомах углерода наиболее приближены друг к другу (такая конформация называется заслоненной), и обладающую минимальной энергией, когда атомы водорода наиболее удалены друг от друга (такая конформация называется заторможенной). Разность энергий предельных конформаций 12 кДж/моль. Эта величина достаточно велика, чтобы утверждать, что в данный момент времени абсолютное большинство молекул этана находятся в заторможенной конформации. Вместе с тем эта величина слишком мала, чтобы препятствовать вращению одной метильной группы относительно другой.
В более сложных органических молекулах возможна большая разность энергий конформаций и тогда вращение относительно одинарной связи может быть затруднено или отсутcтвовать вообще.”
