Орієнтовні об’єкти екскурсій
ПРОГРАМА З ХІМІЇ
для 10–11 класів
загальноосвітніх навчальних закладів
Профільний рівень
ПОЯСНЮВАЛЬНА ЗАПИСКА
Вступ. Програма призначена для навчання учнів хімії на профільному рівні у класах біолого-хімічного, хіміко-технологічного, фізико-хімічного, агрохімічного профілів. Як профільний навчальний предмет хімія включає курси неорганічної (10-й клас), органічної та загальної хімії (11-й клас). Зміст курсів ґрунтується на знаннях, набутих учнями в основній школі. Профілізація забезпечується не лише поглибленим вивченням хімії, посиленням міжпредметних зв’язків, а й упровадженням спецкурсів, факультативів та курсів за вибором.
Мета профільного навчання хімії полягає у забезпеченні загальноосвітньої профільної та допрофесійної підготовки з хімії згідно з освітніми потребами, нахилами, здібностями учнів; розвитку в них засобами навчального предмета хімії ключових компетентностей, необхідних для соціалізації і творчої реалізації особистості; набуття навичок самостійної науково-практичної та дослідницько-пошукової діяльності.
Реалізація загальної мети досягається виконанням таких завдань:
- розвиток особистості учня, його природних задатків, інтелекту, пам’яті, здатності до самоосвіти, навчально-пізнавальних і професійних інтересів на основі засвоєння системи знань про речовини та їх перетворення, закони й теорії хімії, методи наукового пізнання; формування наукового світогляду;
- розвиток уявлень учнів про сучасну природничо-наукову картину світу, загальнокультурне значення й гуманістичну спрямованість хімічної науки, технологічне застосування законів хімії, її роль у розв’язуванні таких глобальних проблем людства, як сировинна, енергетична, продовольча, екологічна; вироблення в учнів розуміння суспільної потреби у необхідності дальшого розвитку хімічної науки і промисловості;
- розкриття біологічної ролі хімічних елементів та їх найважливіших неорганічних і органічних сполук;
- створення умов для самовизначення і саморозвитку особистості, формування ставлення до хімії як до можливої галузі майбутньої професійної діяльності;
- виховання дбайливого ставлення до природи, розвиток екологічної культури, навичок безпечного поводження з речовинами у побуті.
Характеристика структури навчальної програми.Програма курсу 10-го класу з неорганічної хімії для профільного навчання базується на знаннях, набутих учням в основній школі. Проте їх явно недостатньо для того, щоб розкрити особливості хімічних елементів та їх сполук, пояснити залежність між складом, будовою, властивостями, способами добування і застосування речовин. Тому, перш ніж розпочати вивчення систематичного курсу, програмою передбачено як повторення основних хімічних понять, так і поглиблення їх змісту й розширення обсягу, а також уведення деяких нових хімічних понять. Зміст програми складають чотири розділи.
Розділ 1 “Повторення та поглиблення найважливіших теоретичних питань курсу хімії основної школи” передбачає повторення і поглиблення знань: а) про будову атома за рахунок розгляду енергії йонізації та спорідненості до електрона, збудженого стану атома, електронної конфігурації атомів елементів ІV періоду періодичної системи, ознайомлення з d-елементами; б) про будову речовини та окисно-відновні реакції, ознайомлення з їх типами, в) вивчення нового поняття “гідроліз солей”.
Розділи ІІ “Неметалічні елементи та їх сполуки” і ІІІ “Металічні елементи та їх сполуки” мають подібне структурування навчального матеріалу, що забезпечує однакову логічну послідовність розгляду всіх груп хімічних елементів за алгоритмом: положення елемента в періодичній системі – будова атома та його характеристики – будова простої речовини та її фізичні й хімічні властивості – склад, будова, фізичні та хімічні властивості найважливіших сполук – поширення у природі та біологічна роль елементів – добування і застосування, вплив елементів та їх сполук на організм людини і довкілля.
У розділі ІV “Промислове виробництво найважливіших неорганічних речовин” розглядаються промислові способи добування сульфатної кислоти, амоніаку, чавуну та сталі; хімічні реакції, що лежать в їх основі, та закономірності керування їх перебігом, основні наукові принципи виробництв та екологічні проблеми, що з ними пов’язані.
У змісті курсу узагальнюються, поглиблюються та розширюються теоретичні знання учнів про хімічну реакцію. Так, вивченню промислового виробництва сульфатної кислоти передує опанування знань про хімічну рівновагу, які в подальшому використовуються і закріплюються під час вивчення виробництва амоніаку. У процесі розгляду способів добування металів вводиться поняття електролізу розплавів і водних розчинів речовин.
Програма курсу 11-го класу з органічної хімії для профільного навчання передбачає поглиблене вивчення питань електронної і просторової будови речовин. Розглядаються різні стани гібридизації електронів атомів Карбону, Оксигену, Нітрогену, електронні ефекти в молекулах, механізми реакцій заміщення і приєднання, поняття про конформації вуглеводів та асиметричний атом Карбону. До програми додатково (порівняно з академічним рівнем) включено такі класи і групи речовин, як кетони, нітросполуки, ангідриди й хлорангідриди карбонових кислот, гетероциклічні сполуки. Зважаючи на специфіку профілю, більше уваги приділено біологічно активним речовинам – жирам, вуглеводам, білкам, нуклеїновим кислотам, взаємозв’язку їхньої будови, рівнів структурної організації з біологічними функціями. У програмі розширено відомості про синтетичні високомолекулярні речовини та полімерні матеріали на їх основі. У заключному розділі розглядається значення органічного синтезу для розв’язування продовольчої, сировинної, енергетичної, екологічної проблем, розвитку біо- та нанотехнологій. Практична частина програми містить практикум з елементами функціонального аналізу органічних речовин та розв’язування експериментальних задач.
Зміст заключного розділу хімії ґрунтується на знаннях учнів, набутих у попередніх розділах, і присвячено систематизації та узагальненню знань про неорганічні та органічні речовини на спільній теоретичній основі. Матеріал структурується навколо основних блоків знань – про речовину, хімічну реакцію закони і теорії хімії в житті суспільства.
У програмі посилено практичну спрямованість змісту і збільшено увагу до хімічного експерименту, що дає учням змогу переконатися у значенні хімічного експерименту як важливого методу наукового пізнання властивостей речовин і має неабияке значення у підготовці до зовнішнього незалежного оцінювання з хімії.
У структурі змісту навчального матеріалу передбачено години для розв’язування розрахункових задач в усіх класах (10-11), що має суттєве значення для активізації розумової діяльності учнів і свідомого засвоєння матеріалу.
Окрім змісту навчального матеріалу, у програмах з хімії для 10-11 класів визначено вимоги до навчальних досягнень учнів за кожною з тем і виокремлено такі структурні підрозділи, як “Розрахункові задачі”, “Демонстрації”, “Лабораторні досліди”, “Практичні роботи”, “Міжпредметні зв’язки”, “Орієнтовні об’єкти екскурсій”.
Особливості організації навчання. Профільне навчання хімії передбачає не лише поглиблене засвоєння учнями хімічних понять, законів, теорій, передбачених Державним стандартом базової і повної загальної середньої освіти, а й широке використання знань із споріднених предметів та дослідницьку діяльність учнів. При цьому особливого значення набуває позакласна робота з хімії. Хімічні гуртки, олімпіади, участь у роботі МАН, підготовка рефератів дають змогу розвивати дослідницькі навички тих учнів, які найбільше цікавляться хімією.
У профільному навчанні хімії неабиякого значення набуває саморозвиток і самоосвіта учнів. Цьому сприяє збільшення у навчанні частки самостійної роботи учнів, у тім числі з комп’ютером та іншими джерелами інформації.
Профільне навчання хімії передбачає орієнтацію учнів на професії, що потребують використання хімічних знань, у тім числі на інженерні й робітничі професії хімічного та споріднених виробництв, наприклад сталевар, горновий, оператор, апаратник, хімік-технолог, хімік-дослідник, лікар, агроном, агрохімік, лаборант хімічного аналізу, фармацевт, менеджер фірми з виробництва та постачання хімічних реактивів тощо. Саме тому особливістю профільного навчання хімії є обов’язкове проведення навчальних екскурсій на промислові або сільськогосподарські об’єкти (залежно від профілю).
Рекомендації щодо роботи з програмою. Розподіл часу за темами програми орієнтовний. Вчитель може залежно від умов вносити обґрунтовані зміни у розподіл часу на вивчення окремих тем, а також обґрунтовано змінювати послідовність вивчення окремих питань у межах навчальної теми. При цьому слід пам’ятати, що в процесі тематичного планування 50 відсотків навчального часу потрібно відводити на семінарські заняття і практичні роботи.
Учитель має право на свій розсуд вирішувати, як виконати той чи інший експеримент. Окремі демонстрації можна виконувати як лабораторні досліди, а лабораторні досліди – як практичні роботи, але не навпаки. Деякі досліди можна замінювати доступнішими в умовах конкретної школи.
Резервні години використовують для тематичного оцінювання й аналізу його результатів і коригування знань, а також для проведення навчальних екскурсій.
Й клас
(4 год на тиждень, усього 140 годин із них 15 год – резервних)
НЕОРГАНІЧНА ХІМІЯ
| К-ть годин | Зміст навчального матеріалу | Державні вимоги до загальноосвітньої підготовки учнів |
| Розділ І. Повторення та поглиблення основних теоретичних питань курсу основної школи | ||
| Класифікація хімічних елементів і речовин. Властивості основних класів неорганічних сполук. Обчислення за хімічними рівняннями маси, кількості речовини, об’єму реагентів і продуктів реакції. Сучасні уявлення про будову атомів. Нукліди. Ізотопи. Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Характеристики атомів елементів: радіус атома, електронегативність і закономірності зміни їх у періодах і групах. Будова електронних оболонок атомів елементів І-ІV періодів періодичної системи. Електронна та графічно-електронна конфігурації атомів s-, p-, d-елементів. Характеристика хімічного елемента за його положенням у періодичній системі та будовою атома. Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення. Атомні, молекулярні, йонні, металічні кристалічні ґратки. Залежність фізичних властивостей речовин від їхньої будови. Валентність і ступінь окиснення елементів у основному та збудженому станах атомів. Окисно-відновні реакції. Розчини. Процес розчинення речовин. Характеристики кількісного складу розчинів: масова частка та молярна концентрація розчиненої речовини. Обчислення молярної концентрації розчину. Гідроліз водних розчинів солей. | Учень (учениця) називає - хімічні елементи та їх сполуки; наводить приклади: - s-, p-, d-елементів; - сполук з різним типом кристалічних ґраток; - розчинів; - різних випадків гідролізу; формулює означення: - основних класів неорганічних сполук з точки зору електролітичної дисоціації; - ізотопів, електронегативності, радіусу атома; - окисно-відновних реакцій; - розчинів, масової частки розчиненої речовини, молярної концентрації; - гідролізу солей; - сучасне означення періодичного закону; характеризує - хімічні елементи за їх положенням у періодичній системі та будовою атомів; складає: - електронні та графічно-електронні формули атомів елементів; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; класифікує - хімічні елементи та речовини; пояснює: - механізми утворення різних типів хімічних зв’язків; - теплові явища при розчиненні речовин; обґрунтовує: - закономірності змін будови атомів елементів та їх властивостей у періодичній системі; - залежність фізичних властивостей речовин від їх будови; прогнозує - фізичні властивості речовин у залежності від їх будови; експериментально розв’язує задачі - на генетичний зв’язок між класами неорганічних сполук; виготовляє - розчини солі заданої молярної концентрації; визначає - реакцію середовища водних розчинів солей; обчислює: - масу, кількість речовини, об’єм реагентів і продуктів реакції за рівнянням реакції; - молярну концентрацію речовини у розчині; дотримується правил безпеки під час виконання хімічних дослідів. | |
| Розрахункові задачі: 1. Обчислення молярної концентрації розчиненої речовини у розчині. 2. Обчислення за хімічними рівняннями реакцій маси, кількості, об’єму реагентів і продуктів реакції. Демонстрації: 1. Таблиці: періодична система хімічних елементів Д.І.Менделєєва (короткий і довгий варіанти); розчинності кислот, основ і солей у воді; ряд електронегативностей елементів. 2. Моделі кристалічних ґраток. 3. Теплові явища при розчиненні концентрованої сульфатної кислоти (кристалічного натрій гідроксиду) та амоній нітрату. 4. Зміна кольору при розчиненні безводного купрум(ІІ) сульфату. 5. Зміна об’єму при розчиненні спирту у воді. Лабораторні досліди. 1. Гідроліз водних розчинів солей і визначення їхнього середовища. Практичні роботи: 1. Узагальнення відомостей про основні класи неорганічних сполук. 2. Виготовлення розчину солі заданої молярної концентрації. Міжпредметні зв’язки: математика:найменше спільне кратне; фізика:атом, атомне ядро, ядерна модель атома, електрон, йон;формула густини рідини;біологія: хімічні елементи найважливіші для організму людини; основи здоров’я:необхідність контролю за якістю води, повітря, харчових продуктів. | ||
| Розділ ІІ. Неметалічні елементи та їхні сполуки | ||
| Тема 1. Гідроген. Водень Гідроген. Місце у періодичній системі. Будова атома. Ізотопи. Поширеність Гідрогену в природі Водень. Склад молекули і будова речовини. Добування. Фізичні та хімічні властивості: взаємодія з неметалами, металами, оксидами металів, етеном(етиленом) та етином (ацетиленом). Застосування водню. Об’ємні відношення газів у хімічних реакціях. Закон об’ємних відношень газів. Розрахунки за законом об’ємних відношень газів | Учень (учениця) називає - ізотопи та сполуки Гідрогену; формулює - закон об’ємних відношень газів; характеризує: - Гідроген за його місцем у періодичній системі та будовою атома; - поширеність у природі; - фізичні та хімічні властивості водню; - способи добування; складає: - електронну та графічно-електронну формули атома Гідрогену; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; обґрунтовує - місце Гідрогену в періодичній системі; - валентність та ступені окиснення; оцінює - роль водню як екологічно чистого палива; експериментально - добуває, збирає і перевіряє водень на чистоту; обчислює - об’єм речовин у хімічних реакціях за законом об’ємних відношень газів; дотримуєтьсяправил безпечного поводження з воднем. | |
| Розрахункові задачі. 3.Розрахунки за законом об’ємних відношень газів. Демонстрації: 6.Добування водню в лабораторії та способи його збирання. 7. Перевірка водню на чистоту. 8. Горіння водню в кисні. 9. Взаємодія водню з купрум(ІІ) оксидом. Практичні роботи: 3. Відновні властивості водню. Міжпредметні зв’язки: математика:пропорція, пряма пропорційна залежність; фізика:об’єм та одиниці об’єму; біологія:біологічна роль Гідрогену в живих системах. | ||
| Тема 2. Елементи VІІ-А групи (галогени) Загальна характеристика елементів групи: Флуор, Хлор, Бром, Йод. Поширеність їх у природі. Хлор як проста речовина. Склад молекули і будова речовини. Фізичні властивості хлору. Способи добування хлору. Хімічні властивості хлору: взаємодія з воднем, металами, водою, лугами, метаном, етеном і етином. Поняття про ланцюгову реакцію. Хлорна вода. Застосування хлору. Гідроген хлорид. Склад молекули і будова речовини. Фізичні властивості. Добування та застосування гідроген хлориду (хлороводню). Хлоридна кислота. Фізичні та хімічні властивості: взаємодія з металами, з основними та амфотерними оксидами та гідроксидами, солями. Хлориди. Розчинність хлоридів у воді. Якісна реакція на хлорид-іони. Застосування хлоридної кислоти та хлоридів. Обчислення за рівнянням хімічної реакції маси або кількості речовини продукту, якщо один з реагентів узято в надлишку. Фтор, бром і йод. Порівняння фізичних і хімічних властивостей простих речовин: взаємодія з металами, воднем, водою. Якісні реакції на бромід-, йодид-іони, йод. Застосування сполук Флуору, Брому та Йоду. Біологічне значення галогенів. Проблема охорони довкілля від забруднення сполуками Хлору. | Учень (учениця) називає - елементи-галогени та їхні сполуки; наводить приклади - основних природних сполук галогенів та їх родовищ в Україні; формулює - означення вільного радикалу; характеризує: - елементи та прості речовини галогенів; - фізичні та хімічні властивості галогенів, хлоридної кислоти, хлоридів; - способи добування хлору; - поширеність галогенів у природі; - практичне значення галогенів та їхніх сполук, вплив на довкілля; складає: - електронні та графічно-електронні формули атомів галогенів; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; пояснює: - сутність ланцюгових реакцій на прикладі взаємодії хлору з воднем; - біологічну роль галогенів та їхніх сполук; порівнює: - елементи галогени за їхнім положенням в періодичній системі і будовою атомів; - фізичні та хімічні властивості їхніх сполук; експериментально визначає - хлорид-, бромід-, йодид-іони та йод; розв’язує - експериментальні задачі; обчислює - масу, об’єм (газуватих речовин), або кількість речовини продукту за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку; дотримуєтьсяправил безпечного поводження з хлорною, бромною, йодною водою, хлоридною кислотою. | |
| Розрахункові задачі: 4.Обчислення маси, об’єму (газуватих речовин), або кількості речовини продукту за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку. Демонстрації: 10.Зразки хлору, брому, йоду, сполук галогенів. 11.Сублімація йоду. 12. Добування гідроген хлориду та розчинність його у воді. 13. Хімічні властивості хлоридної кислоти. 14. Витіснення галогенів один одним із розчинів галогенідів. Лабораторні досліди: 2.Якісні реакції на хлорид-, бромід-, йодид-іони та йод. Практичні роботи: 4. Хімічні властивості хлоридної кислоти. 5. Розв’язування експериментальних задач „Сполуки галогенів”. Міжпредметні зв’язки: біологія:біологічна роль галогенів, значення хлоридної кислоти для травлення в шлунку; географія:нерудні корисні копалини України; основи здоров’я:захворювання, що виникають внаслідок нестачі йоду в організмі, наслідки уражання шкіри та очей хімічними речовинами. | ||
| Тема 3. Елементи VI-А групи Загальна характеристика елементів VI-А групи. Поширеність елементів у природі. Оксиген. Прості речовини Оксигену: кисень та озон. Порівняння фізичних та хімічних властивостей озону та кисню. Їх біологічна роль. Значення озонового шару для життя організмів на Землі. Сульфур. Прості речовини Сульфуру: ромбічна, моноклінна, пластична сірка. Фізичні та хімічні властивості: взаємодія з металами, неметалами. Застосування. Обчислення кількості речовини, маси або об’єму продукту реакції за відомою кількістю речовини, масою або об’ємом вихідної речовини, яка містить домішки. Гідроген сульфід. Фізичні та хімічні властивості: взаємодія з киснем. Сульфідна кислота та сульфіди. Якісна реакція на сульфід-іони. Фізіологічна дія сірководню. Сульфур(IV) оксид і сульфітна кислота. Їх окисно-відновні властивості. Сульфур(VІ) оксид. Сульфатна кислота. Фізичні та хімічні властивості розведеної та концентрованої сульфатної кислоти: взаємодія з металами, основними й амфотерними оксидами та гідроксидами, солями. Водовідбірні властивості. Сульфати. Якісна реакція на сульфат-іони. Застосування сульфатної кислоти та сульфатів. | Учень (учениця) називає - елементи VI-А групи та їхні сполуки; - прості речовини Оксигену та Сульфуру; наводить приклади - основних природних сполук елементів VI-А групи та їх родовищ в Україні; характеризує: - елементи групи; - прості речовини Оксигену та Сульфуру; - фізичні та хімічні властивості простих речовин, оксидів і кислот Сульфуру; - поширеність у природі Оксигену та Сульфуру; практичне значення кисню, сірки та сполук Оксигену і Сульфуру; - біологічну роль Оксигену, Сульфуру та їх сполук; складає: - електронні та графічно-електронні формули атомів елементів групи; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; пояснює - причини кислотних дощів; порівнює: - елементи VI-А групи за їхнім положенням в періодичній системі і будовою атомів; - фізичні та хімічні властивості їхніх сполук; - прості речовини Оксигену та Сульфуру; експериментально: - доводить властивості розбавленої сульфатної кислоти; - визначає сульфід-, сульфіт- і сульфат-іони в розчинах; розв’язує - експериментальні задачі; обчислює - кількість речовини, масу або об’єм продукту реакції за відомою кількістю речовини, масою або об’ємом вихідної речовини, що містить домішки; дотримується правил безпечного поводження з розчином сульфатної кислоти. | |
| Розрахункові задачі: 5.Обчислення кількості речовини, маси або об’єму продукту реакції за відомою кількістю речовини, масою або об’ємом вихідної речовини, яка містить домішки. Демонстрації: 15.Зразки сірки та інших природних сполук Сульфуру. 16.Взаємодія кисню з неметалами та металами. 17.Добування сульфур(IV) оксиду реакцією обміну та ознайомлення з його властивостями. 18. Взаємодія концентрованої сульфатної кислоти з металами. 19.Дія концентрованої сульфатної кислоти на цукор. Лабораторні досліди: 3.Хімічні властивості розведеної сульфатної кислоти та сульфатів. 4.Якісні реакції на сульфід-, сульфіт- та сульфат- іони. Практичні роботи: 6.Розв’язування експериментальних задач „Сполуки Сульфуру”. Міжпредметні зв’язки: математика: відсоткові розрахунки; біологія:біологічна роль Оксигену та Сульфуру, фотосинтез, дихання рослин, дихання тварин, газообмін у легенях людини; географія: поширення сульфуровмісних корисних копалин в Україні; основи здоров’я:наслідки ураження шкіри та очей хімічними речовинами. | ||
| Тема 4. Елементи V-А групи Загальна характеристика елементів V-А групи. Поширеність їх у природі. Біологічна роль Нітрогену і Фосфору. Азот. Склад молекули і будова речовини. Фізичні та хімічні властивості: взаємодія з металами, воднем і киснем. Добування, застосування. Амоніак. Склад молекули і будова речовини. Фізичні та хімічні властивості: взаємодія з водою, кислотами, горіння та каталітичне окиснення. Донорно-акцепторний механізм утворення йону амонію. Фізіологічна дія амоніаку. Лабораторні способи добування амоніаку. Обчислення виходу продукту реакції від теоретичного. Солі амонію. Фізичні та хімічні властивості: взаємодія з лугами, солями, розкладання при нагріванні, гідроліз. Якісна реакція на йон амонію. Застосування амоніаку та солей амонію. Нітроген(ІІ) оксид і нітроген(ІV) оксид. Фізичні та хімічні властивості: окисно-відновні, відношення до води та лугів. Фізіологічна дія на організм. Захист довкілля від оксидів Нітрогену. Нітратна(азотна) кислота. Фізичні та хімічні властивості розведеної та концентрованої нітратної кислоти: розкладання на світлі та при нагріванні, взаємодія з металами та деякими неметалами, основними й амфотерними оксидами та гідроксидами, солями, дія на органічні сполуки. Якісна реакція на нітрат-іони. Застосування нітратної кислоти. Нітрити та нітрати. Фізичні та хімічні властивості: розкладання при нагріванні. Проблема вмісту нітратів і нітритів у харчових продуктах. Застосування нітратів. Колообіг Нітрогену в природі. Фосфор. Прості речовини Фосфору: червоний, білий, чорний фосфор. Фізичні та хімічні властивості: взаємодія з киснем, галогенами, металами. Добування. Застосування фосфору. Фосфор(V) оксид. Фізичні та хімічні властивості: взаємодія з водою, лугами, основними оксидами. Застосування. Ортофосфатна кислота. Фізичні та хімічні властивості: особливості електролітичної дисоціації, взаємодія з основними оксидами, лугами і солями. Фосфати і гідроген фосфати. Якісна реакція на фосфат-іони. Застосування. Колообіг Фосфору в природі. Азотні та фосфорні мінеральні добрива. Проблема охорони довкілля при використанні мінеральних добрив. | Учень (учениця) називає: - елементи V-А групи та їхні сполуки; - прості речовини Фосфору; наводить приклади: - основних природних сполук Нітрогену та Фосфору; - мінеральних добрив; характеризує: - елементи групи за їхнім місцем у періодичній системі та будовою атома; - прості речовини Фосфору; - фізичні та хімічні властивості азоту, фосфору, амоніаку, оксидів, кислот і солей Нітрогену та Фосфору; - поширеність елементів та їх сполук у природі; - застосування сполук Нітрогену та Фосфору; - азотні та фосфатні мінеральні добрива; складає: - електронні та графічно-електронні формули атомів Нітрогену і Фосфору; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; порівнює: - елементи V-А групи за їхнім положенням у періодичній системі та будовою атомів; - фізичні та хімічні властивості сполук Нітрогену та Фосфору; - прості речовини Фосфору; пояснює - колообіг Нітрогену та Фосфору в природі; висловлює судження - про вплив сполук Нітрогену та Фосфору на довкілля; експериментально: - доводить властивості амоніаку, розбавленої нітратної і ортофосфатної кислот; - визначає амоній-, нітрат- і ортофосфат-іони; оцінює - значення азотних і фосфорних добрив для підвищення врожайності сільськогосподарських культур; обчислює - вихід продукту від теоретичного; дотримується - правил безпечного поводження з амоніаком і розбавленою нітратною кислотою. | |
| Розрахункові задачі: 6.Обчислення виходу продукту від теоретичного. Демонстрації: 20.Добування амоніаку реакцією обміну. 21. Розчинення амоніаку у воді („фонтан”). 22. Взаємодія амоніаку з гідроген хлоридом. 23. Термічне розкладання солей амонію. 24. Взаємодія розбавленої та концентрованої нітратної кислоти з міддю. 25. Спалахування скипидару в нітратній кислоті. Лабораторні досліди: 5. Якісна реакція на амоній-іон. 6. Якісна реакція на ортофосфат-іон. 7. Ознайомлення із зразками азотних і фосфатних добрив. Практичні роботи: 7. Добування амоніаку та досліди з ним. 8. Визначення мінеральних добрив. 9. Розв’язування експериментальних задач „Сполуки Нітрогену та Фосфору”. Міжпредметні зв’язки: біологія: біологічна роль Нітрогену і Фосфору, живлення рослин, використання мінеральних добрив у сільському господарстві; основи здоров’я:наслідки ураження шкіри та очей хімічними речовинами. | ||
| Тема 5. Елементи IV-А групи Загальна характеристика елементів IV-А групи. Поширеність їх у природі. Біологічна роль Карбону та Силіцію. Карбон. Прості речовини Карбону: алмаз, графіт, карбін. Їхня будова. Фізичні та хімічні властивості: взаємодія з металами, активними неметалами, оксидами металів, водяною парою. Адсорбція. Розв’язування задач за термохімічними рівняннями реакцій. Карбон(ІІ) оксид(чадний газ). Склад молекули і будова речовини. Фізичні та хімічні властивості: горіння, взаємодія з оксидами металічних елементів. Фізіологічна дія карбон(ІІ)оксиду на живі організми. Способи добування. Застосування. Карбон(IV) оксид(вуглекислий газ). Склад молекули і будова речовини. Фізичні та хімічні властивості: взаємодія з водою, оксидами, лугами, вуглецем. Способи добування. Застосування. Фізіологічна дія та біологічна роль карбон(IV) оксиду. Парниковий ефект. Карбонатна(вугільна) кислота. Карбонати та гідрогенкарбонати. Хімічні властивості: взаємодія з кислотами, розкладання при нагріванні, гідроліз водних розчинів. Взаємоперетворення карбонатів і гідрогенкарбонатів. Якісна реакція на карбонат-іони. Поширеність карбонатів у природі. Застосування. Колообіг Карбону в природі. Силіцій. Прості речовини Силіцію: кристалічний і аморфний силіцій. Їхня будова. Фізичні та хімічні властивості: взаємодія з металами, неметалами та розчинами лугів. Застосування силіцію. Силіцій(ІV) оксид. Склад і будова речовини. Фізичні та хімічні властивості: взаємодія з магнієм, вуглецем, флуоридною кислотою. Застосування. Силікатна(кремнієва) кислота Фізичні властивості. Силікати. Природні та штучні. Силікатні матеріали: скло, цемент, кераміка. | Учень (учениця) називає: - елементи IV-А групи та їхні сполуки; - прості речовини Карбону та Силіцію; наводить приклади: - основних природних сполук Карбону і Силіцію та їхніх родовищ в Україні; - силікатних матеріалів; формулює - означення адсорбції; характеризує: - елементи групи за їхнім місцем у періодичній системі та будовою атома; - прості речовини Карбону і Силіцію; - фізичні та хімічні властивості вуглецю та силіцію, оксидів, кислот, солей Карбону та Силіцію; - способи добування карбон(ІІ) оксиду і карбон(IV) оксиду; - поширеність Карбону, Силіцію та їхніх сполук у природі; складає: - електронні та графічно-електронні формули атомів елементів IV-А групи;\ - рівняння відповідних хімічних реакцій, - схеми електронного балансу окисно-відновних реакцій; пояснює: - біологічну роль Карбону та Силіцію; - сутність адсорбції, парниковий ефект; - колообіг Карбону в природі; порівнює: - неметалічні властивості елементів IV-А групи; - прості речовини Карбону та Силіцію; висловлює судження - про вплив оксидів Карбону на довкілля; оцінює - практичне значення явища адсорбції; - наслідки парникового ефекту; експериментально: - доводить властивості карбон(IV) оксиду, взаємоперетворення карбонатів і гідрогенкарбонатів; - визначає наявність карбонат-іонів; розв’язує - розрахункові задачізатермохімічними рівняннями реакцій; - експериментальні задачі на властивості карбонатів і силікатів; дотримується правил безпеки під час виконання хімічних дослідів. | |
| Розрахункові задачі. 7.Розрахунки за термохімічними рівняннями реакцій. Демонстрації. 26. Кристалічні ґратки алмазу та графіту. 27. Адсорбція активованим вугіллям розчинених у воді барвників (фуксин, лакмус тощо). Лабораторні досліди. 8. Перетворення карбонатів у гідрогенкарбонати і навпаки. 9. Якісна реакція на карбонат-іони. 10.Ознайомлення зі зразками мінералів. Практичні роботи. 10.Добування карбон(IV) оксиду та вивчення його властивостей. Розпізнавання карбонатів. Міжпредметні зв’язки. фізика: кількість теплоти, одиниці вимірювання теплоти, електрична провідність матеріалів (провідники, напівпровідники та діелектрики); біологія:біологічна роль Карбону та Силіцію, фотосинтез, дихання рослин, дихання тварин, газообмін у легенях і тканинах людини; географія: паливні корисні копалини; основи здоров’я:наслідки отруєння побутовим газом; | ||
| Розділ ІІІ. Металічні елементи та їхні сполуки | ||
| Тема 1. Загальні відомості про металічні елементи та метали Положення металічних елементів у періодичній системі. Особливості будови їх атомів. Поширеність у природі. Метали. Металічний зв’язок. Характерні фізичні та хімічні властивості металів: взаємодія з неметалами, водою, лугами, кислотами, розчинами солей. Обчислення за рівняннями реакцій між розчином солі та металом. Корозія металів. Види корозії: хімічна та електрохімічна. Захист від корозії. Поняття про сплави. Загальні способи добування металів із руд. Поняття про металургію. Пірометалургія, гідрометалургія, електрометалургія, мікробіометалургія. Електроліз водних розчинів та розплавів безоксигенових солей. | Учень (учениця) називає - s-, p-, d-металічні елементи; наводить приклади - металічних руд, сплавів; формулює - означення корозії; характеризує: - положенняметалічнихелементів за їхнім місцем у періодичній системі; - характерні фізичні та хімічні властивості металів, їх поширеність у природі; - біологічну роль металічних елементів; складає: - електронні та графічно-електронні формули атомів металічних елементів; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; пояснює: - утворення металічного зв’язку; - будову металів; - сутність хімічної та електрохімічної корозії; - захист металів від корозії; обґрунтовує: - властивості металічних елементів та їх сполук; - поширеність металічних елементів у природі; оцінює : - практичне значення металів; прогнозує: - можливість перебігу реакцій за рядом активності металів; висловлює судження: - про наслідки корозії металів; розв’язує: - задачі на обчислення за рівнянням реакції між розчином солі та металом; дотримується правил безпеки під час виконання хімічних дослідів. | |
| Розрахункові задачі: 8.Обчислення за рівняннями хімічних реакцій між розчином солі та металом. Демонстрації: 28.Моделі кристалічних ґраток металів. 29. Витіснення міді з купрум(ІІ) сульфату залізом. 30. Взаємодія металів з неметалами. 31. Досліди, що ілюструють корозію металів та захист від неї. 32. Взаємодія цинку (алюмінію) з натрій гідроксидом. Лабораторні досліди: 11.Ознайомлення із зразками металів, природними сполуками металічних елементів, сплавами. 12. Взаємодія металів із розчинами солей. 13. Взаємодія металів із розчинами кислот. Міжпредметні зв’язки: фізика: електричний струм у металах; географія: рудні корисні копалини, родовища залізної, марганцевої та руд кольорових металів; трудове навчання: механічні властивості металів. | ||
| Тема 2. Металічні елементи І-А – ІІІ-А груп Загальна характеристика хімічних елементів 1-А групи. Натрій і Калій – типові представники лужних елементів. Поширеність їх у природі. Фізичні та хімічні властивості натрію і калію: взаємодія з неметалами і водою, відношення до кислот. Сполуки Натрію і Калію (оксиди, гідроксиди, солі). Застосування. Біологічна роль Натрію і Калію. Загальна характеристика хімічних елементів ІІ-А групи. Магній і Кальцій - представники лужноземельних елементів. Поширеність їх у природі. Фізичні та хімічні властивості магнію і кальцію: взаємодія з неметалами, водою, кислотами, солями. Сполуки Кальцію та Магнію (оксиди, гідроксиди, солі). Твердість води та способи її усунення. Біологічна роль Магнію і Кальцію. Застосування сполук Магнію і Кальцію. Алюміній. Характеристика елемента. Поширеність у природі. Фізичні та хімічні властивості алюмінію: взаємодія з неметалами, водою, кислотами та лугами, оксидами металічних елементів. Оксид і гідроксид Алюмінію, їхні амфотерні властивості. Застосування сполук Алюмінію. | Учень (учениця) називає - металічніелементи І-А – ІІІ-А груп та їхні сполуки; наводить приклади: - природних сполук Натрію, Калію, Кальцію, Магнію, Алюмінію та їхніх родовищ; - сплавів магнію та алюмінію; - калійних добрив; характеризує: - поширеність елементів І-А – ІІІ-А груп у природі; елементи Натрій, Калій, Магній, Кальцій, Алюміній за їхнім місцем у періодичній системі та будовою атома; - фізичні та хімічні властивості натрію, калію, магнію, кальцію, алюмінію та їхніх найважливіших сполук; складає: - електронні та графічно-електронні формули атомів елементів Натрію, Калію, Магнію, Кальцію, Алюмінію; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; пояснює: - амфотерність алюміній гідроксиду; - сутність твердості води; порівнює - властивості оксидів і гідроксидів лужних, лужноземельних елементів і Алюмінію; обґрунтовує: - застосування металів І-А -ІІІ-А груп і сполук елементів їхніми властивостями; - роль калійних добрив; висловлює судження - про значення твердості води у промисловості та побуті; експериментально - визначаєйони 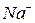 , , 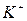 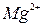 , , 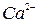 , , 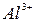 у солях; обчислює - вміст металів у їхній суміші; розв’язує - експериментальні задачі; дотримуєтьсяправил безпеки під час виконання хімічних дослідів. у солях; обчислює - вміст металів у їхній суміші; розв’язує - експериментальні задачі; дотримуєтьсяправил безпеки під час виконання хімічних дослідів. | |
| Розрахункові задачі: 9.Розрахунки вмісту металів у їхній суміші. Демонстрації: 33.Зразки природних сполук Натрію, Калію, Магнію, Кальцію, Алюмінію. 34. Горіння магнію в кисні. 35. Взаємодія натрію та кальцію з водою. 36. Забарвлення полум’я солями Натрію, Калію, Кальцію, Магнію. 37. Механічна міцність оксидної плівки алюмінію. 38. Усунення твердості води. Лабораторні досліди: 14.Взаємодія кальцій оксиду з водою. 15. Добування алюміній гідроксиду і доведення його амфотерних властивостей. Практичні роботи: 11. Хімічні властивості гідроксидів металічних елементів І-А - ІІІ-А груп. 12. Розв’язування експериментальних задач з теми „Металічні елементи І-А - ІІІ-А груп”. Міжпредметні зв’язки: математика: алгебраїчне рівняння з однією змінною, система двох рівнянь з двома невідомими, їх розв’язання способами підстановки та додавання; біологія:біологічна роль Натрію, Калію та Кальцію, використання калійних добрив;географія: нерудні корисні копалини України. | ||
Тема 3. Ферум. Залізо Ферум. Характеристика елемента. Поширеність у природі. Біологічна роль. Фізичні та хімічні властивості заліза: взаємодія з неметалами, водою, кислотами, солями. Сполуки Феруму (II) і Феруму (III): оксиди, гідроксиди, солі. Якісні реакції на йони 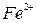 , , 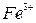 . Застосування. . Застосування. | Учень (учениця) називає - сполуки Феруму; наводить приклади: - природних сполук Феруму; - сплави заліза; характеризує: - Ферум за його місцем у періодичній системі та будовою атома; - фізичні та хімічні властивості заліза та його сполук із ступенями окиснення +2, +3; - якісні реакції на йони 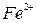 і і 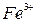 ; - поширеність Феруму у природі ; складає: - електронну та графічно-електронну формули атома Феруму; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; порівнює - властивості оксидів і гідроксидів Феруму (ІІ) і (ІІІ); обґрунтовує - застосування заліза та його сплавів; висловлює судження про біологічну роль Феруму; експериментально визначає солі Феруму (II) і (III); розв’язує експериментальні задачі; дотримуєтьсяправил безпеки під час виконання хімічних дослідів. ; - поширеність Феруму у природі ; складає: - електронну та графічно-електронну формули атома Феруму; - рівняння відповідних хімічних реакцій; - схеми електронного балансу окисно-відновних реакцій; порівнює - властивості оксидів і гідроксидів Феруму (ІІ) і (ІІІ); обґрунтовує - застосування заліза та його сплавів; висловлює судження про біологічну роль Феруму; експериментально визначає солі Феруму (II) і (III); розв’язує експериментальні задачі; дотримуєтьсяправил безпеки під час виконання хімічних дослідів. | |
| Демонстрації: 39. Природні сполуки Феруму. 40. Спалювання заліза в кисні. 41. Характерні реакції на йони Феруму (ІІ) і (ІІІ). 42. Зразки сплавів заліза. 43. Окиснення ферум(ІІ) гідроксиду до ферум(ІІІ) гідроксиду. Лабораторні досліди: 16. Добування ферум(ІІ) і ферум(ІІІ) гідроксидів. Взаємодія їх із кислотами. 17. Відновні властивості йона Феруму(ІІ) (взаємодія ферум(ІІ) сульфату із розчином калій перманганату в кислому середовищі). 18. Окиснювальні властивості йона Феруму(ІІІ) (взаємодія ферум(ІІІ) хлориду з калій йодидом або натрій сульфітом). 19. Гідроліз солей Феруму (ІІ) і (ІІІ). Практичні роботи: 13.Розв’язування експериментальних задач з “Металічні елементи та їхні сполуки”. | ||
| Розділ IV. Промислове виробництво найважливіших неорганічних речовин | ||
| Загальні наукові принципи хімічного виробництва: вибір сировини, теплообмін, протитечія, безперервність, автоматизація та механізація виробничих процесів. Хімічна рівновага. Оборотні й необоротні реакції. Умови зміщення хімічної рівноваги. Принцип Ле Шательє. Керування хімічними процесами: зміна швидкості реакції та зміщення хімічної рівноваги. Промислове виробництво сульфатної кислоти. Сировина. Основні стадії виробництва. Хімічні реакції, що лежать в основі її виробництва контактним способом, закономірності їх перебігу і керування ними. Охорона навколишнього середовища від забруднення промисловими викидами. Кислотні дощі. Синтез амоніаку в промисловості. Оптимальні умови та наукові принципи синтезу амоніаку. Виробництво заліза та його сплавів. Доменний процес вироблення чавуну, його хімізм. Сталь. Пряме відновлення заліза з руди. Промислове добування заліза – основа чорної металургії. Екологічні проблеми, що пов’язані з металургією, шляхи їх розв’язування. | Учень (учениця) називає: - основні наукові принципи, сировину та етапи виробництв сульфатної кислоти, амоніаку, чавуну та сталі; формулює: - означення електролізу, оборотних та необоротних реакцій, хімічної рівноваги; - принцип Ле Шательє; складає: - рівняння відповідних хімічних реакцій; - схеми електродних процесів; пояснює: - сутність електролізу; - вплив різних чинників на перебіг реакції та хімічну рівновагу; характеризує - виробництва сульфатної кислоти, амоніаку, чавуну та сталі; обґрунтовує - найважливіші наукові принципи та оптимальні умови зазначених виробництв; оцінює - екологічну небезпеку хімічних виробництв. |
Й клас
( 6 год на тиждень, усього 210 годин із них 20 год – резервних )
ОРГАНІЧНА ХІМІЯ
