Электропроводность растворов электролитов
Основные понятия.
Удельная электропроводность.
Прямым доказательством существования ионов в растворах электролитов является способность растворов проводить электрический ток. Эта способность обусловлена движением положительно заряженных ионов к отрицательным электродам и отрицательно заряженных ионов к положительным электродам. Количественной характеристикой способности растворов электролитов проводить электрический ток является электропроводность.
Электропроводность – это величина обратная сопротивлению;
L = 1/R (2.1)
В свою очередь сопротивление R зависит от длины проводника l, площади поперечного сечения δ и удельного сопротивления ρ.
R = ρ * l / δ (Ом) (2.2)
Подставив значение R в уравнение 2.1 получим
L = 1/ρ * δ / ℓ Ом-1 = См (сименс)
L = æ L = æδ/ ℓ
Величина обратная удельному сопротивлению называется удельной электропроводностью и обозначается буквой æ (каппа).
Удельная электропроводность раствора электролита, представляет собой электропроводность 1 м3 раствора, помещенного между параллельными электродами площадью 1 м2 и расстоянием между ними 1 м и измеряется в См * м-1.
Так как электричество переносится ионами различных знаков, движущимися в противоположных направлениях, то общее количества электричества, проходящее через раствор в 1 сек., т.е. сила тока I, складывается из количеств электричества переносимых соответственно катионами I+ и анионами I-:
I = I+ + I- (2.3)
Если обозначить скорость движения катионов V+ (м/с), скорость движения анионов через V- (м/с), эквивалентную концентрацию ионов Сi (экв./ м3), поперечное сечение цилиндрического сосуда через δ (м2), расстояние между электродами через l (м) и разность потенциалов между электродами через Е (В), то количество катионов, проходящих через поперечное сечение электролита в 1 сек. будет равно:
n+ = V+ * δ * С+, т.е.
за это время в одну сторону через сечение пройдут все катионы, находящиеся в начальный момент на расстоянии не более чем V+ (м) от выбранного сечения, т.е. все катионы в объеме V+ * δ.
А так же каждый эквивалент ионов согласно закону Фарадея F = 96500 Кл. электричества, то сила тока:
I+ = n+ * F = V+ * δ * С+ * F
Аналогично, для анионов
I- = V- * δ * С- * F
Общая сила тока составит:
I = I+ + I- = (V+ + V-) * δ * Сi * F (2.4)
Скорость движения ионов V+ и V- зависят от природы ионов, концентрации, температуры, напряженности поля.
Пусть все факторы, кроме напряженности поля, постоянны, скорость в этом случае пропорциональна только предложенной силе.
Напряженность электрического поля, это силовая характеристика электрического поля - разность потенциалов между двумя точками в вольтах деленная на расстояние между ними l в метрах (В/м)
В этом случае:
V+ = 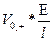 (2.5)
(2.5)
V- = 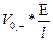 (2.5)
(2.5)
Где, 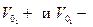 коэффициенты пропорциональности соответствующие скорости ионов при напряженности поля в 1 В/м, называют абсолютными скоростями движения ионов. И имеют размерность м/с * м/В = м2/ В*с
коэффициенты пропорциональности соответствующие скорости ионов при напряженности поля в 1 В/м, называют абсолютными скоростями движения ионов. И имеют размерность м/с * м/В = м2/ В*с
Подставив выражение (2.5) в уравнение (2.4) получим:
I = 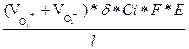 (2.6)
(2.6)
По закону Ома I = 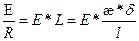 (2.7)
(2.7)
Приравняв правые части уравнения (2.6) и (2.7), получим:
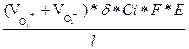 =
= 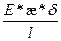 => æ = (
=> æ = ( 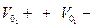 ) * Сi * F
) * Сi * F
Но Сi = СН * α * 1000 и в этом случае уравнение примет вид.
æ = ( 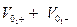 )* F * СН * α * 1000 (См * м-1) (2.8)
)* F * СН * α * 1000 (См * м-1) (2.8)
Входящие в уравнение абсолютные скорости ионов зависят от концентрации ионов в растворе, что объясняется электростатическим взаимодействием между ними.
С уменьшением концентрации ионов, увеличивается расстояние между ними и уменьшается взаимодействие их зарядов, что приводит к увеличению абсолютных скоростей ионов.
При бесконечном разбавлении растворов абсолютные скорости достигают максимального значения.
Абсолютные скорости ионов при данной концентрации и при бесконечном разбавлении можно связать равенством.
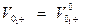 * fλ
* fλ
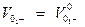 * fλ
* fλ
Где fλ – коэффициент электропроводности
Он равен
fλ = 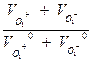
Вводя понятие коэффициента электропроводности fλ получим более общее уравнение
æ = 1000 * СН * α * fλ *( 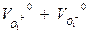 )* F (2.9)
)* F (2.9)
Так как скорости движения ионов очень малы, часто пользуются величинами в F раз большими. Они называются подвижностями ионов и обозначаются λ+ и λ- (лямда) и имеют размерность ( 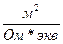 )
)
λ+ = 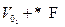 λ- =
λ- = 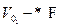 (2.10)
(2.10)
если рассматривать абсолютные скорости при бесконечном разбавлении, то можно говорить и о подвижностях ионов при бесконечном разбавлении
λ+0 = 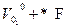 λ-0 =
λ-0 = 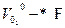 (2.11)
(2.11)
Пользуясь подвижностями уравнение (2.9)примет вид
æ = 1000 * СН * α * fλ * (λ+0 + λ-0) (2.12)
где α – степень диссоциации,
а fλ – коэффициент учитывающий изменение скорости ионов с концентрацией – характеризует межионной взаимодействие.
Для сильных электролитов α = 1, а для слабых электролитов fλ = 1.
Согласно полученного уравнения удельная электропроводность должна увеличиваться с увеличением концентрации.
Однако, если концентрация становится достаточно большей, то дальнейшее ее увеличение приводит к уменьшению α для слабых электролитов и fλ для сильных.
Влияние этих факторов может оказываться более сильным, чем увеличение общей концентрации, что вызовет падение æ от концентрации (с).
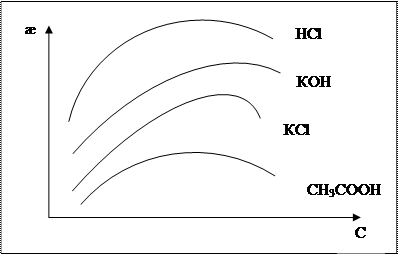 |
Рис. 4.1 Зависимость удельной электропроводности от концентрации
в водных растворах электролита.
