I тип реакций. Реакции, характерные для органических кислот.
Ароматические сульфокислоты
| общая формула | 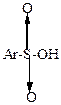 |
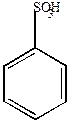 | 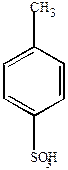 | 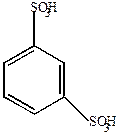 |
| Бензолсульфокислота | П-толуолсульфокислота | М-бензолдисульфокислота |
Получают, в основном, путем сульфирования ароматических углеводородов.
1) При использовании серной кислоты в качестве сульфирующего агента необходимо брать избыток кислоты, т.к. при разбавлении серной кислоты до 65% реакция сульфирования прекращается, наступает равновесие.
Для смещения равновесия можно брать также избыток бензола, и образующуюся воду отгоняют в виде азеотропов с бензолом.
2) Особенно хорошо идет реакция сульфирования при действии олеума.
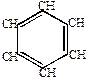 |  |  | 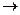 | 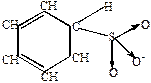 | 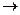 |  | |
| оксид серы | биполярный ион | 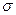 -комплекс -комплекс | |||||
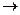 | 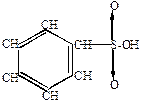 |
Реакция идет при действии эквимолекулярного количества SO3 при комнатной температуре.
C6H5-SO2-OH + H-C6H5 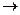 -HOH -HOH | 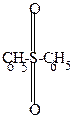 |
Физические свойства
Обусловлены наличием очень полярной сульфогруппы. Сульфокислоты имеют высокие температуры кипения и перегоняются только в глубоком вакууме. Это кристаллические вещества, бесцветные, очень гигроскопичные, прекрасно растворяются в воде, плохо – в органических растворителях.
Химические свойства
Сульфокислоты ароматического ряда - вещества достаточно высокой реакционной способности. Среди ароматических соединений сульфокислоты имеют такое же значение, как галогенопроизводные среди соединений жирного ряда.
I тип реакций. Реакции, характерные для органических кислот.
1) Образование солей.
Сульфокислоты относятся к сильным кислотам (по степени диссоциации близки к серной кислоте)
ArSO3H 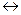 ArSO3- + H+
ArSO3- + H+
Они легко образуют соли, например,
2 C6H5SO3H + Na2CO3 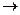 2 C6H5SO3Na + H2O + CO2
2 C6H5SO3Na + H2O + CO2
Na-соли арилсульфокислот хорошо растворимы в воде, и для выделения их в кристаллическом виде прибегают к приему высаливания. Na-соли сульфокислот обладают хорошими моющими свойствами. Их можно использовать в жесткой, даже морской, воде, т.к. кальциевые, магниевые соли сульфокислот растворимы в горячей воде.
2) Образование хлорангидридов сульфокислот.
C6H5SO2OH + PCl5 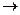 POCl3 + HCl + C6H5SO2Cl
POCl3 + HCl + C6H5SO2Cl
бензолсульфохлорид
Сульфохлориды – кристаллические вещества, нерастворимые в воде, разлагаются водой только при кипячении. Являются хорошими ацилирующими средствами для спиртов, фенолов, аминов.
3) Образование амидов.
Легче всего протекает при действии аммиака или аминов на сульфохлорид.
С6H5-SO2Cl + NH3 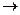 C6H5-SO2-NH2
C6H5-SO2-NH2
-HCl
бензолсульфохлорид бензолсульфамид
или
С6H5-SO2Cl + NH2С6H5 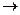 C6H5-SO2-NH-C6H5
C6H5-SO2-NH-C6H5
-HCl
анилин N-фенилбензолсульфамид
Сульфамиды трудно растворимы, хорошо кристаллизуются и используются для идентификации и выделения сульфокислот.
Сульфамиды способны к замещению водородов амидной группы на Сl.
С6H5SO2NH2 + HOCl 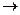 HOCl -2H2O HOCl -2H2O | 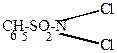 |
| хлорноватистая кислота | хлорамин Б |
Такие вещества обладают хорошими дезинфицирующими и отбеливающими свойствами, т.к. в присутствии воды разлагаются с выделением атомарного кислорода.
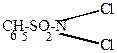 | + HOCl 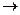 2HCl + С6H5SO2NH2 + 2O HOCl 2HCl + С6H5SO2NH2 + 2O HOCl |
| бензолсульфамид |
4) образование сложных эфиров.
Чаще всего осуществляется действием сульфохлорида на спирты или фенолы.
С6H5SO2Cl + HOC2H5 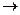 HCl + C6H5SO2OC2H5
HCl + C6H5SO2OC2H5
бензолсульфохлорид этанол этиловый эфир бензолсульфокислоты
С6H5SO2Cl + HOC6H5 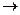 HCl + C6H5SO2OC6H5
HCl + C6H5SO2OC6H5
бензолсульфохлорид фенол фениловый эфир БСК
