Заполнение электронами энергетических уровней атомов
| Сумма п + l | п | l | Состояние | Сумма п + 1 | п | l | Состояние |
| 1s | 4d | ||||||
| 5p | |||||||
| 2s | 6s | ||||||
| 2р | 4f | ||||||
| 3s | 5d | ||||||
| 6p | |||||||
| 3р | 7s | ||||||
| 4s | |||||||
| 5f | |||||||
| 3d | 6d | ||||||
| 4р | 7р | ||||||
| 5s | 8s |
Пример 1. Учитывая описанные закономерности, рассмотрите состояние и распределение электронов по энергетическим уровням и орбиталям для атомов калия (Z = 19) и скандия (Z = 21).
Решение
1) Предшествующий калию в ПСХЭ элемент аргон (Z = 18) имеет следующее распределение электронов:
а) по уровням атома:
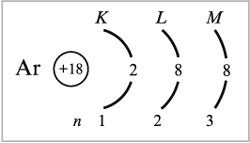
б) по орбиталям атома:
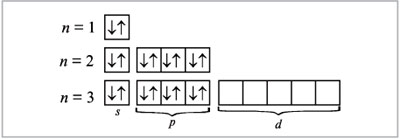
Электронная формула атома аргона:
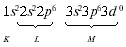
Электронно-графическая формула атома аргона:
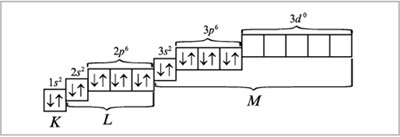
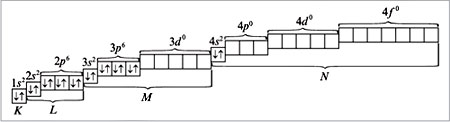
При распределении электронов в атоме К в соответствии с правилом Клечковского предпочтение отдается орбитали 4s (сумма квантовых чисел n + l равна: 4 + 0 = 4) по сравнению с орбиталью 3d (сумма квантовых чисел n + l равна: 3 + 2 = 5) как орбитали, имеющей минимальное значение n + l. Следовательно, для атома калия распределение электронов по орбиталям (электронно-графическая формула) имеет вид (см. п. 16 методических указаний):
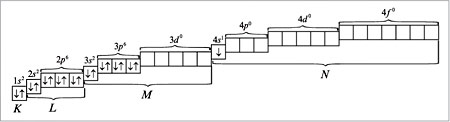
Калий относится к s-элементам со следующей электронной формулой (конфигурацией) атома:
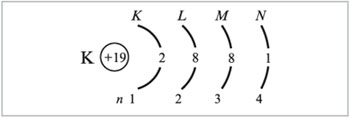
Распределение электронов по энергетическим уровням для атома К изображено ниже:
2) Предшествующий скандию в ПСХЭ элемент кальций (Z = 20) имеет следующее распределение электронов:
а) по уровням атома:
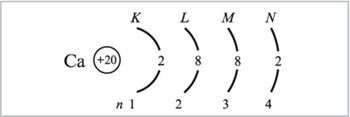
б) по орбиталям атома:
Электронная формула атома кальция:
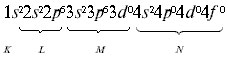
Из орбиталей 3d (n + l равно: 3 + 2 = 5) и 4p (n + l равно: 4 + 1 = 5) при распределении электронов в атоме скандия по орбиталям предпочтение следует отдать 3d-орбитали как имеющей минимальное значение n = 3 при одинаковых суммах квантовых чисел (n + l), равных пяти. Следовательно, скандий относится к d-элементам, и его атом характеризуется следующим распределением электронов по орбиталям:
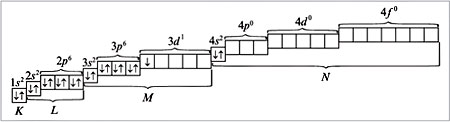
Электронная формула атома скандия:
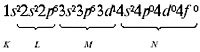
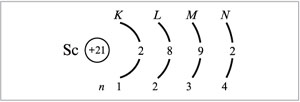
Распределение электронов по энергетическим уровням для атома Sc изображено ниже:
Пример 2. Дополните рисунок так, чтобы показать вид одной s-орбитали и трех р-орбиталей, ориентированных вдоль осей.

Число элементов в периоде таблицы Д.И.Менделеева определяется формулами:
а) для нечетных периодов:
Ln = (n + 1)2/2,
б) для четных периодов:
Ln = (n + 2)2/2,
где Ln – число элементов в периоде, n – номер периода.
Строгая периодичность расположения элементов в ПСХЭ Д.И.Менделеева полностью объясняется последовательным заполнением энергетических уровней атомов. Укреплению позиций периодического закона на основе закономерностей изменения электронной структуры атомов элементов, впервые предсказанных Н.Бором, способствовало открытие 72-го элемента. Еще не открытый тогда элемент химики искали среди минералов, содержащих редкоземельные элементы, исходя из неправильной предпосылки, что к лантаноидам следует отнести 15 элементов.
По аналогии с переходными элементами число лантаноидов (элементы № 58–71) должно быть равно разности между максимальными числами электронов на N и М энергетических уровнях
(32 – 18 = 14), т. е. равно максимальному числу электронов на f-подуровне. Элемент с Z = 72 (гафний Hf) является аналогом циркония Zr и был обнаружен в циркониевых рудах.
Следующим важным выводом является вывод о периодичности заполнения электронами внешних энергетических уровней атомов, чем обусловлена периодичность изменения химических свойств элементов и их соединений.
Таблица
