Происхождение атомных эмиссионных спектров
Атомы и ионы всех химических элементов могут находиться в нормальном (основном) и возбужденном состояниях. В нормальном состоянии атомы обладают минимальной энергией Е0 и в этом состоянии не излучают. Под влиянием внешних воздействий (высокая температура, столкновение с быстролетящими частицами) атомы получают дополнительную энергию и переходят в возбужденное состояние, при этом происходит переход преимущественно валентных электронов с нормального энергетического уровня Е0 на более высокий Еi:
| B E0 |
| B* |
| B |
| Ei |
| hν1 |
| hν2 |
| hν3 |
ΔE1=E1–E0=hν1=hc/l1
ΔE2=E2–E0=hν2=hc/l2
………………………………..
SΔEi=S(Ei–E0)= Shνi=Shc/li,
где h – постоянная Планка; ν – частота излучения; с – скорость света; l – длина волны излучения.
По истечении очень короткого времени (~10–8 с) каждый возбужденный атом самопроизвольно (спонтанно) возвращается в нормальное состояние (или какое-либо устойчивое промежуточное), при этом избыточная энергия излучается в виде квантов света hνi.
Каждый переход электрона с возбужденного энергетического уровня на устойчивое состояние с меньшей энергией сопровождается излучением кванта света, но так как в излучении принимают участие много атомов с различными начальными энергиями и переход возбужденных электронов осуществляется на различные устойчивые состояния, то энергия и длины волн излучаемых квантов тоже различные. У каждого элемента наблюдается своя совокупность (Shc/li) квантов света с различными длинами волн.
При разложении испускаемого излучения по длинам волн в наблюдаемых (или фотографируемых) спектрах каждому электронному переходу соответствует определенная линия, а сам спектр называется линейчатым. Положение линий в спектре элемента определяется только природой химического элемента и не зависит от его концентрации. Число линий в спектре определяется числом электронных переходов, преимущественно валентных электронов. Так как энергия излучаемых квантов элемента различная, то и интенсивность линий в спектре тоже различная.
Наиболее яркие линии в спектре элемента называют аналитическими. Самые интенсивные (яркие) линии в спектрах элементов наблюдаются при переходах электронов с самого нижнего возбужденного уровня на основной. Такие линии называют резонансными. Одним из наиболее замечательных свойств атомных спектров является их дискретность (т.е. линейчатая структура) и сугубо индивидуальный характер, что делает такие спектры опознавательным признаком каждого элемента. То есть атомный эмиссионный спектр каждого химического элемента характеризуется только ему свойственной комбинацией спектральных линий. На этом основан качественный анализ. Количественное же определение элементов основано на измерении интенсивности квантов излучения по наиболее ярким аналитическим линиям в спектрах элементов.
В плазме возбужденные и невозбужденные атомы находятся в термодинамическом равновесии в соответствии с законом Больцмана:
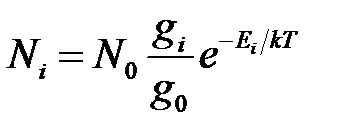 ,
,
где Ni и N0 – концентрации атомов в возбужденном и основном состояниях, соответственно; gi и g0 – статистические веса этих состояний; Ei – энергия возбужденного уровня i, эВ; Т – абсолютная температура.
Интенсивность спектральной линии, соответствующей переходу электрона с i-го уровня на основной, описывается выражением:
Ii0=NiAi0hνi0,
где Ai0 – вероятность спонтанного перехода электрона с уровня i на основной; h – постоянная Планка; ν – частота излучения, с–1.
При постоянной температуре Т число возбужденных атомов Ni пропорционально числу атомов N0, т.е. фактически общему числу атомов в плазме атомизатора. Интенсивность спектральных линий возрастает пропорционально концентрации N0 невозбужденных атомов в плазме, а, следовательно, и концентрации элемента в пробе, но только в области малых концентраций. При более высоких концентрациях атомов пропорциональная зависимость интенсивности линий от N0 нарушается вследствие эффекта самопоглощении испускаемого излучения плазмой. Влияние самопоглощения в наибольшей степени проявляется при резонансных переходах, так как в этом случае фотоны поглощаются атомами, находящимися в основном (невозбужденном) состоянии, которые преобладают в плазме (Ni<<N0). Тем не менее, для достаточно широкого интервала концентраций элемента в пробе зависимость интенсивности I спектральной линии от концентрации с элемента в анализируемой пробе можно выразить эмпирическим уравнением Ломакина-Шайбе:
I=aсb, (2.1)
где а – коэффициент, зависящий от свойств источника возбуждения и пробы; b – коэффициент, учитывающий самопоглощение излучения в плазме атомизатора.
К сожалению, самопоглощение излучения не единственная помеха в проведении АЭСА. При электронных переходах с близкими энергиями существует вероятность наложения спектральных линий при их уширении. Ширина спектральной линии увеличивается с ростом ее интенсивности. Кроме того, на ширину спектральной линии оказывают влияние и другие факторы – это естественное уширение, обусловленное конечным «временем жизни» возбужденного состояния (10–4–10–5 нм), доплеровское уширение, обусловленное хаотическим тепловым движением атома (Δl≈10–3 нм), лоренцевское (ударное) уширение, обусловленное столкновениями с другими атомами (Δl≈10–3 нм). Однако, уширение линий в эмиссионных спектрах атомов с учетом влияния всех возможных факторов, как правило, не превышает величины Δl≈10–3 нм, что практически не влияет на положение аналитических линий в спектрах элементов.
Если в анализируемом образце содержится несколько элементов, то для получения аналитической информации следует выбирать такие участки спектра, где аналитические линии элементов не перекрываются. Аналогично поступают, когда проявляется заметное влияние сопутствующего фона. Среди физико-химических помех, влияющих на интенсивность спектральных линий, следует отметить также неполноту атомизации пробы и ионизацию атомов, которые уменьшают концентрацию N0 «атомного пара» в плазме и, в конечном счете, уменьшают концентрацию Ni возбужденных атомов, формирующих аналитический сигнал.
Для подавления физико-химических помех и поддержания постоянства температуры применяют так называемые спектроскопические буферы. Для уменьшения образования труднодиссоциирующих оксидов вводят в плазму соединения металлов, образующих более прочные оксиды, а ионизацию атомов определяемых элементов подавляют введением в пробу щелочных металлов с низкими потенциалами ионизации, например, К (Еион.=4.34 эВ), Na (Еион.=5.14 эВ).
