Кл электричества выделит y г
y = 0,3 г
Пример 3. При пропускании через раствор нитрата серебра тока силой 0,804 А в течение 2 часов на катоде выделилось 6,156 г серебра. Определите выход серебра по току.
Решение: по закону Фарадея (см. Задача №1) находим m(Ag)теор = 6,48 г. Таким образом, выход по току равен:
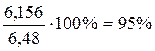
Контрольные задачи к теме 8(часть1)
(Электродные потенциалы, гальванический элемент)
1. Устройство и работа стандартного медно-водородного гальванического элемента. ЭДС = 0,34 В. Чему равен E°Cu2+/Cu?
2. Устройство и работа стандартного цинково-водородного гальванического элемента. ЭДС = 0,76 В. Чему равен E°Zn2+/Zn?
3. Вычислите ЭДС стандартного марганцево-цинкового гальванического элемента и приведите электронно-ионные уравнения процессов, происходящих на электродах. E°Mn2+/Mn = -1,18 В; E°Zn2+/Zn = -0,76 В.
4. Вычислите ЭДС гальванического элемента, образованного из кадмия и свинца. Приведите уравнения процессов, происходящих на электродах в стандартных условиях. E°Cd2+/Cd = -0,40 В; E°Pb2+/Pb = -0,13 В.
5. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и железного электрода, погруженного в 1 М раствор сульфата железа (II).
6. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и никелевого электрода, погруженного в 0,01 М раствор сульфата никеля.
7. Составьте схемы двух гальванических элементов, в одном из которых никель служил бы катодом, а в другом – анодом. Вычислите ЭДС этих элементов.
8. Составьте схемы двух гальванических элементов, в одном из которых медь является катодом, а в другом – анодом. Напишите уравнения электродных процессов.
9. Составьте схему работы гальванического элемента, образованного никелем и свинцом, погруженными в 0,01 М растворы их солей. Рассчитайте ЭДС этого элемента.
10. Вычислите ЭДС гальванического элемента, состоящего из медного электрода, погруженного в 0,01 М раствор сульфата меди (II) и медного электрода, погруженного в 0,1 М раствор сульфата меди (II).
11. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и железного электрода, погруженного в 1 М раствор сульфата железа (II).
12. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и медного электрода, погруженного в 1 М раствор сульфата меди.
13. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и кадмиевого электрода, погруженного в 0,1 М раствор сульфата кадмия.
14. Составьте схемы двух гальванических элементов, в одном из которых кадмий служил бы катодом, а в другом – анодом. Вычислите ЭДС этих элементов.
15. Составьте схемы двух гальванических элементов, в одном из которых олово является катодом, а в другом – анодом. Напишите уравнения электродных процессов.
16. Составьте схему работы гальванического элемента, образованного никелем и оловом, погруженными в 0,01 М растворы их солей. Рассчитайте ЭДС этого элемента.
17. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и никелевого электрода, погруженного в 0,01 М раствор сульфата никеля (II).
18. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,01 М раствор сульфата цинка и медного электрода, погруженного в 1 М раствор сульфата меди.
19. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 0,1 М раствор хлорида цинка и оловянного электрода, погруженного в 0,1 М раствор хлорида олова (II).
20. Составьте схемы двух гальванических элементов, в одном из которых никель служил бы катодом, а в другом – анодом. Вычислите ЭДС этих элементов.
21. Составьте схемы двух гальванических элементов, в одном из которых серебро является катодом, а в другом – анодом. Напишите уравнения электродных процессов.
22. Составьте схему работы гальванического элемента, образованного никелем и серебром, погруженными в 0,01 М растворы их солей. Рассчитайте ЭДС этого элемента.
23. Вычислите ЭДС стандартного марганцево-цинкового гальванического элемента и приведите электронно-ионные уравнения процессов, происходящих на электродах. E°Mn2+/Mn = -1,18 В; E°Zn2+/Zn = -0,76 В.
24. Вычислите ЭДС гальванического элемента, состоящего из цинкового электрода, погруженного в 1 М раствор сульфата цинка и никелевого электрода, погруженного в 0,1 М раствор сульфата никеля (II).
25. Составьте схему работы гальванического элемента, образованного цинком и оловом, погруженными в 0,1 М растворы их солей. Рассчитайте ЭДС этого элемента.
Контрольные задачи к теме 8(часть 2)
1. Сколько меди выделится на катоде, если через раствор медного купороса пропустить ток силой 1,34 А в течение 30 мин?
2. Для золочения ложки её погрузили в качестве катода в раствор тетрахлораурата (III) натрия – Na[AuCl4]. Электролиз продолжался 12 с при силе тока 0,5 А. Рассчитайте массу полученного покрытия.
3. Какой объем кислорода будет получен при электролизе расплавленного гидроксида натрия, током силой 0,2 А в течение 5 часов.
4. Сколько времени займет получение 30 г. меди из раствора медного купороса при силе тока 5А?
5. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора нитрата меди (II): а) угольные электроды, б) медные электроды.
6. Сколько серебра выделится на катоде, если через раствор AgNO3 пропустить ток силой 1,98 А в течение 50 мин?
7. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора SnSO4: а) угольные электроды, б) анод оловянный.
8. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора NiSO4: а) угольные электроды, б) никелевый анод.
9. Какие процессы происходят на катоде и аноде при электролизе а) расплава, б) раствора CaCl2 (электроды графитовые).
10. Какие процессы происходят на катоде и аноде при электролизе а) расплава, б) раствора NaCl (электроды графитовые).
11. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора нитрата серебра: а) угольные электроды, б) серебряные электроды.
12. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора нитрата никеля (II): а) угольные электроды, б) никелевый анод.
13. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора Pb(NO3)2: а) угольные электроды, б) свинцовые электроды.
14. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора Cu(NO3)2: а) угольные электроды, б) медные электроды.
15. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора ZnSO4: а) угольные электроды, б) анод цинковый.
16. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора FeSO4: а) угольные электроды, б) железные электроды.
17. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора KBr с инертными электродами.
18. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора NaNO3 с инертными электродами.
19. Сколько серебра выделится на катоде, если через раствор нитрата серебра пропустить ток силой 2,4 А в течение 60 мин?
20. Какой объем кислорода будет получен при электролизе расплавленного гидроксида калия, током силой 0,5 А в течение 10 часов.
21. Сколько времени займет получение 25 г меди из раствора медного купороса при силе тока 15А?
22. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора ацетата свинца (II): а) угольные электроды, б) свинцовые электроды.
23. Сколько серебра выделится на катоде, если через раствор AgNO3 пропустить ток силой 1,1 А в течение 20 мин?
24. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора ZnSO4: а) угольные электроды, б) анод цинковый.
25. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора NiSO4: а) угольные электроды, б) никелевый анод.
Тема 9. Коррозия металлов
Коррозией металлов называют процесс самопроизвольного разрушения металлов под действием окружающей среды. Различают химическую коррозию — разрушение металлической поверхности под действием сухих газов и электрохимическую коррозию — разрушение металла под действием электролита внешней среды (при контакте двух металлов), сопровождающееся возникновением слабого электрического тока. В основе электрохимической коррозии металлов лежит принцип действия непрерывно работающего гальванического элемента.
Взаимодействие химически чистого металла с водой или с разбавленной кислотой (кроме самых активных металлов) приводит лишь к образованию двойного электрического слоя и возникновению разности потенциалов в месте контакта, которая препятствует дальнейшему протеканию окислительно-восстановительного процесса. Но при соприкосновении двух металлов различной активности (при соединении металлов проводником или при контакте примесей в составе сплава) в среде электролита образуется гальванический элемент, развивается окислительно-восстановительный процесс, протекающий в направлении растворения более активного металла.
Одним из наиболее распространенных способов защиты металлов от электрохимической коррозии является использование катодных и анодных металлических покрытий.
Катодное покрытие — это покрытие менее активным металлом, который будет являться катодом по отношению к защищаемому металлу. Поскольку при электрохимической коррозии окислению подвергается анод, при повреждении катодного покрытия защищаемый металл будет корродировать. Катодная защита основана на подсоединении защищаемого металла к отрицательному полюсу источника постоянного тока.
Анодное (протекторное) покрытие — это покрытие более активным металлом, который будет являться анодом по отношению к защищаемому и при коррозии будет разрушаться, предохраняя защищаемый металл. Протекторная защита основана на соединении металла защищаемого объекта (корпуса судна, цистерны) металлическим проводником с более активным металлом или сплавом (магнием, цинком и т. п.), который служит анодом и растворяется. При этом металл корпуса судна или цистерны не разрушается. Анодом такого микрогальванического элемента всегда является более активный металл (с меньшей алгебраической величиной стандартного электродного потенциала), катодом — менее активный металл. Металл анода всегда подвергается окислению (растворению), тогда как на катоде возможны два основных восстановительных процесса: а) восстановление ионов водорода (коррозия в кислой среде); б) восстановление кислорода в воде (атмосферная коррозия).
Потенциал, отвечающий электродному процессу 2Н++ 2ē = Н2 в нейтральной среде равен -0,41В, ионы водорода в нейтральной среде могут окислить только те металлы, потенциалы которых ниже, т. е. стоящие от начала ряда до кадмия. Потенциал процесса 2H2O + O2 + 4ē = 4OH- в нейтральной среде равен +0,8 В, т. е. вода с растворенным кислородом может окислить большее количество металлов, от начала ряда до серебра. Очевидно, что вода с растворенным в ней кислородом является более активным коррозионным агентом. Таким образом, ионы водорода в кислой среде и кислород в нейтральной среде являются самыми распространенными окислителями, которые восстанавливаются на катодном участке металла. Например, при коррозии цинка в контакте с медью в кислой среде возникает микрогальванический элемент, анодом которого будет цинк. На аноде будет происходить процесс окисления цинка, ионы цинка будут переходить в раствор, а электроны, потерянные атомами цинка, будут переходить на медный участок, заряжая его отрицательно. Ионы водорода будут притягиваться к меди и восстанавливаться на ней.
Пример. Составьте схему процессов, протекающих при атмосферной коррозии омедненного железа.
Решение. Сравниваем стандартные потенциалы железа (-0,44 В) и меди (+0,34 В), вывод – железо – более активный металл. Приводим схему коррозии (Fe | H2O, O2 | Cu) и пишем уравнения реакций:
| А | Fe - 2ē = Fe2+ | |
| К | 2H2O + O2 + 4ē = 4OH- | |
| 2Fe + 2H2O + O2 = 2Fe(OH)2 |
В ходе данной реакции получается гидроксид железа (II) светло-зеленого цвета, в дальнейшем он окисляется:
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (бурого цвета),
а Fe(OH)3 разлагается по схеме:
Fe(OH)3 → H2O + FeOOH (ржавчина).
Суммарное уравнение:
4Fe + 6H2O + 3O2 = 4Fe(OH)3 или 4Fe + 2H2O + 3O2 = 4FeOOH.
