Свинцовые аккумуляторы. Классификация. Назначение. Основные характеристики. Принцип работы
Электрическим аккумулятором называют химический источник тока, который обладает способностью накапливать (аккумулировать) электрическую энергию и отдавать ее по мере надобности. При заряде аккумуляторы подключаются к постороннему источнику постоянного тока. Потребляемая им энергия преобразуется в химическую энергию, которая может длительно сохраняться и легко переходить в электрическую энергию при разряде аккумулятора. При этом израсходованные активные вещества аккумулятора легко восстанавливаются при последующем заряде.
Для питания устройств АТС получили распространение свинцовые и щелочные (железно-никелевые, кадмиево-никелевые) аккумуляторы. В стационарных электропитающих установках используются свинцовые (кислотные) аккумуляторы, имеющие высокий КПД и незначительное снижения напряжения при разряде. Щелочные обладают высокой механической прочностью, поэтому их чаще всего применяют в качестве временных источников энергии или в мобильных системах АТС.
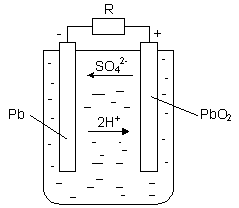 Как видно, свинцовый аккумулятор состоит из двух свинцовый пластин, погруженных в водный раствор серной кислоты. Положительная пластина покрывается перекисью свинца PbO2 – вещество темно-коричневого цвета, а отрицательная пластина состоит из губчатого свинца Pb, который имеет светло-серый цвет. Перекись свинца и губчатый свинец являются активными веществами кислотного аккумулятора. Молекулы серной кислоты под действием растворителя распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка SO4. Если к зажимам аккумулятора подсоединить нагрузку R, то аккумулятор начинает разряжаться. Положительные ионы водорода перемещаются к пластине с перекисью свинца и разряжаются на ней. Образующиеся при этом нейтральные молекулы водорода вступают в реакцию с активной массой перекиси свинца. Реакция на положительной пластине имеет вид: PbO2 + H2 + H2SO4 → PbSO4 + 2·H2O.
Как видно, свинцовый аккумулятор состоит из двух свинцовый пластин, погруженных в водный раствор серной кислоты. Положительная пластина покрывается перекисью свинца PbO2 – вещество темно-коричневого цвета, а отрицательная пластина состоит из губчатого свинца Pb, который имеет светло-серый цвет. Перекись свинца и губчатый свинец являются активными веществами кислотного аккумулятора. Молекулы серной кислоты под действием растворителя распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка SO4. Если к зажимам аккумулятора подсоединить нагрузку R, то аккумулятор начинает разряжаться. Положительные ионы водорода перемещаются к пластине с перекисью свинца и разряжаются на ней. Образующиеся при этом нейтральные молекулы водорода вступают в реакцию с активной массой перекиси свинца. Реакция на положительной пластине имеет вид: PbO2 + H2 + H2SO4 → PbSO4 + 2·H2O.
Отрицательные ионы кислотного остатка SO4 перемещаются к свинцовой пластине и, отдавая ей два электрона, вступают во взаимодействие с губчатым свинцом:
Pb + SO4 → PbSO4.
Таким образом, при разряде аккумулятора на положительной и отрицательной пластинах образуется серно-кислый свинец PbSO4. При образовании PbSO4 расходуется часть находящейся в электролите кислоты. Поэтому разряд аккумулятора сопровождается уменьшением плотности электролита. При глубоком разряде PbSO4 превращается в твердую крупно-кристаллическую соль, которая плохо восстанавливается в процессе заряда. Поэтому необходимо аккумуляторы разряжать до определенной плотности электролита. Для стационарных аккумуляторов плотность электролита при разряде должна составлять 1,17÷1,15 г/см3.
Заряд аккумуляторной батареи осуществляется постоянным током. При заряде аккумуляторной батареи постоянный ток от выпрямителя поступает на положительную пластину, и далее через электролит на отрицательную. На положительную пластину будут поступать отрицательные ионы SO2-, а к отрицательной пластине будут стремиться положительные ионы водорода 2Н+. После разряда ионы нейтрализуются и вступают в химическую реакцию с активной массой. Реакция на положительной пластине описывается уравнением: PbSO4 + SO4 +2H2O → PbO2 + 2H2SO4; реакция на отрицательной пластине описывается уравнением: PbSO4 + H2 → Pb + H2SO4.
Масса положительной и отрицательной пластин восстанавливается, а плотность электролита увеличивается. Стационарные свинцовые аккумуляторы заряжаются до плотности 1,2 – 1,21 г/см3. После этого предела зарядный ток не восстанавливает активную массу на пластинах, а разлагает воду электролита на Н2 и О2, который образует взрывоопасную смесь – «гремучий газ».
ЭДС и напряжение свинцового аккумулятора. Активные вещества положительных и отрицательных пластин обладают определенными потенциалами относительно электролита. Разность этих потенциалов определяет ЭДС аккумулятора, которая не зависит от количества активного вещества в пластинах. ЭДС аккумулятора зависит в основном от плотности электролита, эта зависимость определяется эмпирической формулой: E = 0,85 + d, где d – плотность электролита в порах активной массы пластин. Напряжение аккумулятора при заряде больше, чем величина ЭДС, на величину внутреннего падения напряжения: UЗ = E + IЗ ∙ r0, где r0 – внутреннее сопротивление аккумулятора, а при разряде соответственно: UР = E – IР ∙ r0.
У разряженного свинцового аккумулятора плотность составляет d = 1,17, тогда Е = 0,85 + 1,17 = 2,02 В. У заряженного аккумулятора d = 1,21, тогда Е = 0,85 + 1,21 = 2,06 В => ЭДС разряженного аккумулятора при отключенной нагрузке мало отличается от ЭДС заряженного аккумулятора. При заряде аккумулятора, его напряжение заряда составляет 2,3 – 2,8 В. Напряжение разряда составляет примерно 1,8 В.
Емкость свинцового аккумулятора. Номинальная емкость определяется при десятичасовом разряде до напряжения 1,8 В, при температуре электролита 25°С. Номинальная емкость свинцового аккумулятора составляет 36 А/ч. Этой емкости соответствует ток разряда IР = Q/10 = 3,6 А.
Если изменить ток разряда IР и температуру электролита, то изменится и его емкость. Повышение температуры окружающей среды способствует повышению емкости, но при температуре 40°С происходит коробление положительных пластин и резко увеличивается саморазряд аккумулятора, поэтому для нормальной эксплуатации аккумулятора должна поддерживаться температура + 35°С – 15°С.
Номинальная емкость при температуре 25°С и десятичасовом разряде определяется формулой: QH = IР·tР / {Pt ·[1+0.008·(T-250)]}, где Pt – коэффициент использования активной массы аккумулятора, %; Т – фактическая температура электролита при разряде.
Типы кислотно – свинцовых аккумуляторов. Стационарные аккумуляторы маркируются буквами С, СК, СЗ, СЗЭ, СН и другими: С – стационарный аккумулятор; К – аккумулятор, допускающий кратковременный разряд; З – аккумулятор в закрытом исполнении; Э – эбонитовый сосуд; Н – аккумулятор с намазанными пластинами. Число, которое ставится после буквенного обозначения, означает номер аккумулятора: С-1 – 36 А/ч; С-4 – 4 х 36 А/ч; и другие...
Топливные элементы
ТЭ относятся к числу химических источников электрической энергии. В качестве активных веществ, вступающих в химическую реакцию в ТЭ, используется твердое, жидкое или газообразное топливо (древесный уголь, нефтепродукты, спирты, водород и т.д.). Схематическое устройство ТЭ рассмотрим на основе водородно-кислотного ТЭ.
 Данный ТЭ состоит из положительного 1 и отрицательного 3 электродов, погруженных в щелочной электролит 2. Активным материалом положительного электрода является кислород O2, а отрицательного – водород Н2. Данные активные вещества хранятся отдельно от топливного элемента в особых хранилищах и поступают к электродам лишь во время отдачи им электрической энергии. Электроды ТЭ в реакциях активно не участвуют и в процессе работы не разрушаются, поэтому ТЭ обеспечивают непосредственное преобразование химической энергии в электрическую очень длительное время, пока идет активная подача веществ к его электродам. Расчеты показывают, что топливные элементы могут иметь очень высокие удельные характеристики, мощность и КПД.
Данный ТЭ состоит из положительного 1 и отрицательного 3 электродов, погруженных в щелочной электролит 2. Активным материалом положительного электрода является кислород O2, а отрицательного – водород Н2. Данные активные вещества хранятся отдельно от топливного элемента в особых хранилищах и поступают к электродам лишь во время отдачи им электрической энергии. Электроды ТЭ в реакциях активно не участвуют и в процессе работы не разрушаются, поэтому ТЭ обеспечивают непосредственное преобразование химической энергии в электрическую очень длительное время, пока идет активная подача веществ к его электродам. Расчеты показывают, что топливные элементы могут иметь очень высокие удельные характеристики, мощность и КПД.
Активные вещества подаются к электродам через пористые трубки. Водород вступает в соединение с ионами гидроксила электролита. В результате образуется вода и свободные электроны: 2H2 + 4OH- → 4H2O + 4e.
С водородного электролита свободные электроны перемещаются к кислородному электроду через нагрузку r. В пористом положительном электроде 1 кислород вступает в реакцию с водой электролита, образуя ионы гидроксильного остатка: O2 + 2H2O + 4e → 4OH-.
В результате в замкнутой цепи возникает электрический ток. Расход воды Н2О в элементы восполняет водород, а расход гидроксила ОН- восполняет кислород.
Рассмотренный химический процесс противоположен процессу электролитического разложения воды, где при пропускании тока через электролит вновь образуется кислород и водород. Этим объясняется высокий уровень КПД при выработке электрической энергии.
