Таутомерные превращения органических соединений (кето-енольная, лактам- лактимная, цикло- оксо- таутомерия).
Таутомерияβ-дикарбонильных соединений
Определенная протонная подвижность атома водорода у α-атома углерода в карбонильных соединениях (слабого СН-кислотного центра) проявляется в их способности к реакциям конденсации (см. 5.4). Если подвижность такого атома водорода возрастет настолько, что он сможет отщепиться в виде протона, то это приведет к образованию мезомерного иона (I), отрицательный заряд которого рассредоточен между атомами углерода и кислорода. Обратное присоединение протона к этому иону в соответствии с его граничными структурами может приводить либо к исходному карбонильному соединению, либо к енолу.
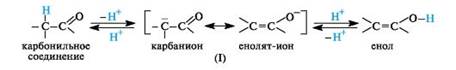
В соответствии с этим карбонильное соединение может существовать в равновесии с изомером - енольной формой. Такой вид изомерии называют таутомерией, а изомеры, находящиеся в состоянии подвижного равновесия, - таутомерами.
Таутомерия - равновесная динамическая изомерия. Ее сущность заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующим перераспределением электронной плотности.
В рассматриваемом случае между кетонной и енольной формами осуществляется перенос протона, поэтому такое равновесие называют прототропной таутомерией, в частности, кето-енольной таутомерией.
В монокарбонильных соединениях (альдегидах, кетонах, сложных эфирах) равновесие практически полностью смещено в сторону кетонной формы. Например, содержание енольной формы в ацетоне составляет всего 0,0002%. При наличии второй электроноакцепторной группы у α-атома углерода (например, второй карбонильной группы) содержание енольной формы возрастает. Так, в 1,3-дикар- бонильном соединении ацетилацетоне (пентандионе-2,4) енольная форма преобладает.
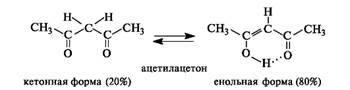
Енольная форма ацетилацетона дополнительно стабилизирована сопряженным со второй π-связью и внутримолекулярной водородной связью.
Многие реакции, включающие образование и превращения карбонильных соединений in vivo, как будет показано в дальнейшем, протекают через промежуточные енольные формы или производные этих форм.
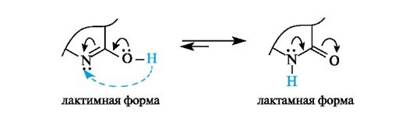
Для 2-гидроксипроизводных гетероциклов, содержащих фрагмент -N=C-OH, типична лактим-лактамная таутомерия как частный случай прототропной таутомерии (см. 9.2.3). Взаимопревращение тауто- мерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную группу ОН, к основному центру - пиридиновому атому азота и обратно. В полярных растворителях и в кристаллическом состоянии лактамные формы явно преобладают, что связано с большим сродством к протону атома азота, нежели атома кислорода.
Три пиримидиновых основания - урацил(2,4-дигидроксипи- римидин), тимин(2,4-дигидрокси-5-метилпиримидин) и цитозин(4-амино-2-гидроксипиримидин) - являются компонентами нуклеотидов и нуклеиновых кислот. Пиримидиновые основания существуют практически только в лактамной форме (лактамный фрагмент выделен цветной рамкой, лактимный - черной).
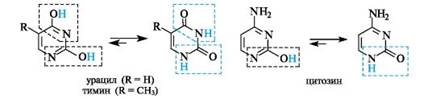
Очевидно, что в лактимной форме, т. е. гидроксиформе, пиримидиновое ядро ароматично. Однако и в лактамной форме ароматичность не нарушена, так как ароматическая система образована в результате участия в сопряжении неподеленной пары электронов «амидного» атома азота. Разрыв сопряжения в кольце отсутствует.
Цикло-оксо-таутомерия
В твердом состоянии моносахариды находятся в циклической форме. В зависимости от того, из какого растворителя была перекристаллизована d-глюкоза, она получается либо в виде a-d-глюкопиранозы (из спирта или воды), либо в виде β-d-глюкопиранозы (из пиридина). Они различаются величиной угла удельного вращения [a]D20, а именно +112? у a-аномера и +19? у β-аномера. У свежеприготовленного растворакаждого аномера при стоянии наблюдается изменение удельного вращения до достижения постоянного, одинакового для того и другого раствора угла вращения +52,5.
Изменение во времени угла вращения плоскости поляризации света растворами углеводов называют мутаротацией.
Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией.
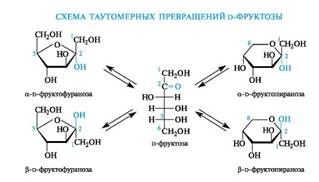
В растворах равновесие между четырьмя циклическими таутомерами моносахаридов устанавливается через открытую форму - оксоформу. Взаимопревращение a- и β-аномеров друг в друга через про- межуточную оксоформу называется аномеризацией.
Таким образом, в растворе d-глюкоза существует в виде таутомеров: оксоформы и a- и β-аномеров пиранозных и фуранозных циклических форм.
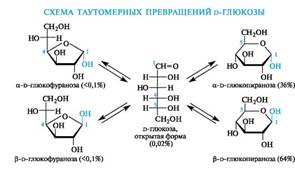
В смеси таутомеров преобладают пиранозные формы. Оксоформа, а также таутомеры с фуранозными циклами содержатся в малых количествах. Важно, однако, не абсолютное содержание того или иного таутомера, а возможность их перехода друг в друга, что приводит к пополнению количества «нужной» формы по мере ее расходования в каком-либо процессе. Например, несмотря на незначительное содержание оксоформы, глюкоза вступает в реакции, характерные для альдегидной группы.
Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных олигосахаридов. Ниже приведена схема таутомерных превращений важнейшего представителя кетогексоз - d-фруктозы, содержащейся во фруктах, меде, а также входящей в состав сахарозы (см. 11.2.2).