Знесолювання (демінералізація) води
Знесолювання полягає у вилученні з води розчинених речовин, перш за все, неорганічних солей. Знесолювання може бути повним, якщо вилучаються всі розчинені солі, або частковим: із води виводяться лише деякі розчинені сполуки чи іони. До часткового знесолювання належить, наприклад, зм’якшення води, яке застосовується також для вилучення із вод, передусім, стічних, іонів важких металів та інших токсичних домішок.
Фізичні методи знесолення діляться на кріогенні та мембранні.
Кріогенні методи здійснюються виморожуванням і кристалізацією газогідратів. Виморожування ґрунтується на різній температурі замерзання водних розчинів і води як розчинника. За температури, нижчої від температури замерзання, вода утворює кристалики льоду. Під час росту кристалика інородні речовини виштовхуються до межі розділу фаз рідина–кристал. Внаслідок цього утворені кристали практично позбавлені домішок. Між кристалами льоду залишається рідина – водний розчин солі (розсіл), температура замерзання якого є, як відомо, нижчою. Густина розсолу переважає густину льоду, внаслідок чого ці фази розшаровуються. Після видалення і промивання лід розтоплюють, отримуючи чисту знесолену воду.
Кристалізація газогідратів відбувається за низьких температур і насичення води деякими газами (вуглеводнями, фреонами, метилхлоридом тощо). При цьому утворюються тверді гідрати (клатрати), які за зовнішнім виглядом нагадують сніг. Подальші стадії одержання знесоленої води такі самі, як і під час виморожування. З підвищеням температури газогідрати розкладаються на воду й газ, який знову подається на стадію утворення газогідратів. Кріогенні методи є ефективними, але високовартісними, а тому зараз у промислових масштабах ще не використовуються.
Мембранні методи знесолення води за сутністю процесів є аналогічними до мембранного розділення рідкофазової сировини (див. ч.1, 4.4.4) – вони ґрунтуються на різній проникності розчинених речовин через напівпроникну мембрану. На перший погляд ці методи є простими, але насправді вони відбуваються за доволі складними механізмами внаслідок дії різних за природою рушійних сил (різниць парціальних тисків, концентрацій, хімічної спорідненості тощо).
Найважливішими мембранними процесами, що застосовуються для повного або часткового знесоленняя, є зворотний осмос, ультра-, нано- та мікрофільтрування, діаліз, первапорація, мембранна дистиляція.
Зворотний осмос – це процес фільтрування розчинів під тиском крізь мембрани, які повністю пропускають молекули води і повністю або частково затримують молекули чи іони розчинених речовин. Якщо до розчину, що знаходиться з одного боку мембрани, прикласти тиск, який перевищує осмотичний тиск розчину певної концентрації, то розчинник буде переноситись у напрямку, протилежному, як у явищі осмосу – відбувається зворотний осмос (гіперфільтрація). Очевидно, що рушійною силою такого процесу є різниця тисків по обидва боки мембрани.
Ультрафільтрування – це процес баромембранного вилучення, а також концентрування і фракціонування розчинів високомолекулярних сполук. Він відбувається під дією різниці тисків з обох боків мембрани, що становить 0,05...0,5 МПа. Ультрафільтрування, на відміну від зворотного осмосу, застосовують для вилучення сполук, молекулярна маса яких є набагато більшою від молекулярної маси води. Схожим на попередній є метод нанофільтрування, але він відбувається за робочих тисків 1...2 МПа і призначений для очищення води від речовин з великими молекулярними масами (до 300...500).
Рушійною силою діалізу є градієнт концентрацій з обох боків мамбран. Процес відбувається з використанням непористих (дифузійних) мембран і застосовується для вилучення речовин з порівняно високою молекулярною масою.
Первапорація – це мембранний процес, рушійною силою якого є різниця парціальних тисків пари або градієнт концентрацій розчиненої речовини по обидва боки мембрани, які створюються внаслідок різниці температур або тисків. Застосовується цей метод переважно для очищення води від летких органічних речовин.
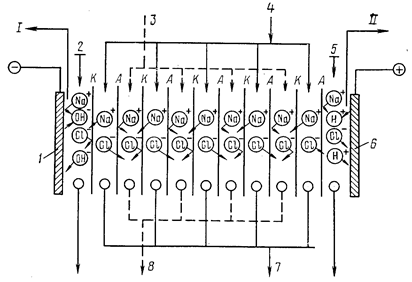
Рис. 4.33. Схема електродіалізатора: 1 – катод; 2 – подавання промивної води
у катодну камеру; 3, 4 – подавання води в розсольну і опріснювальну камери;
5 – подавання промивної води в анодну камеру; 6 – анод; 7 – відведення знесоленої води; 8 – відведення концентрованого розсолу; І – вихід водню; ІІ – вихід кисню і хлору
До фізико-хімічних методів знесолення належить електродіаліз, який полягає у перенесенні іонів електроліту через селективні іонообмінні мембрани під дією електричного постійного струму. Рушійною силою процесу є різниця потенціалів, яка створюється прикладанням до електродів електродіалізатора (рис. 4.33) певної напруги.
Вихідна вода (нехай вона містить натрію хлорид) подається у простір, обмежений аніоно- і катіонообмінними мембранами. До електродів прикладається деяка напруга, внаслідок чого через розчин проходить електричний струм. У напрямку проходження струму (до катода) рухаються катіони (Na+), а у протилежному (до анода) – аніони (Cl-). На катоді (1) виділяється водень, а біля нього збираються ОН- -групи. Тому в катодній камері утворюється NaOH. На аноді виділяється кисень і біля нього збираються протони Водню (Н+), внаслідок чого в анодній камері утворюється HCl. Знесолена вода виводиться із опріснювальних камер (3), а концентровані розчини солей – із розсольних (4).
4.5.2.3.1. Зм’якшення води.Зм’якшення води здійснюють фізико-хімічними та хімічними методами.
Фізико-хімічний (термічний) метод зм’якшення води застосовують для усунення тимчасової твердості. Він полягає в осадженні нерозчинних середніх і основних солей за дії підвищених температур (кип’ятіння):
Ca(HCO3)2 = CaCO3¯ + H2O + СО2; (4.73)
2Mg(HCO3)2 = MgCO3× Mg(OH)2¯ + 3СО2 + H2O. (4.74)
Зараз цей метод використовують не часто, бо утворені осади, осідаючи на теплообмінних поверхнях, різко погіршують теплопередачу від нагріваючого середовища до води. Крім того, цей метод є доволі енергоємним. Термічне зм’якшення доцільно здійснювати тоді, коли воду попередньо обробляють у полі електромагнітних сил, внаслідок чого осад утворюється не на гріючій поверхні, а в об’ємі води у вигляді дрібнодисперсних частинок, які вилучають фільтруванням.
Хімічні методи зм’якшення поділяють на необоротні (реаґентні) та оборотні (іонообмінні).
Реаґентні методи полягають в осадженні малорозчинних сполук Кальцію та Магнію при додаванні до води специфічних реаґентів. Залежно від того, які саме речовини застосовують, реаґентні способи поділяють на вапняний, содовий, фосфатний, натронний.
Вапняний метод полягає в додаванні до води гашеного вапна, унаслідок чого усуваються тимчасова твердість, постійна магнієва твердість та іони Заліза, а також зв’язується СО2 за такими реакціями:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O ; (4.75)
Mg(HCO3)2 + 2Ca(OH)2 = 2CaCO3¯ + Mg(OH)2¯ + 2H2O; (4.76)
MgCl2 + Ca(OH)2 = Mg(OH)2¯ + CaCl2 ; (4.77)
FeSO4 + Ca(OH)2 = Fe(OH)2¯ + CaSO4¯; (4.78)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3¯; (4.79)
CO2 + Ca(OH)2 = CaCO3¯ + H2O . (4.80)
Содовий метод ґрунтується на обробленні води кальцинованою содою, внаслідок чого усувається як тимчасова, так і постійна твердість
Ca(HCO3)2 + Na2CO3 = CaCO3¯ + 2NaHCO3 ; (4.81)
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl . (4.82)
З метою економії реаґенту високої вартості – кальцинованої соди, на практиці зазвичай застосовують комбінований вапняно-содовий спосіб зм’якшення, який передбачає почергове додавання реаґентів: спочатку – гашене вапно, при цьому відбуваються реакції (4.75–4.80), а потім – кальциновану соду, яка усуває залишкову кальцієву твердість (4.81–4.82).
Фосфатний метод застосовують для повнішого усунення катіонів Кальцію та Магнію внаслідок значно меншої розчинності відповідних фосфатів порівняно із карбонатами
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2¯ + 6NaHCO3 ; (4.83)
3MgSO4 + 2Na3PO4 = Mg3(PO4)2¯ + 3Na2SO4 . (4.84)
Оскільки вартість натрію фосфату є значно вищою, ніж кальцинованої соди, то його застосовують лише для усунення залишкової твердості води після її зм’якшення вапняно-содовим способом.
Натронний спосіб пердбачає осадження нерозчинних гідроксидів Кальцію та Магнію внаслідок оброблення води розчином їдкого натру. Однак через значну вартість реаґенту цей спосіб застосовують рідко.
Глибоке зм’якшення води досягається за допомогою іонообмінного методу. У цьому методі для усунення йонів Кальцію і Магнію використовують катіоніти – речовини, які здатні обмінювати свої катіони на еквівалентну кількість йонів Ca2+ i Mg2+, які містяться у воді. Залежно від типу катіона, який здатний до обміну, розрізняють Na-, H-, К-, NH4- та інші катіоніти. Найпоширенішими з них є перші два. Для зм’якшення води методом катіонування використовують Na-катіоніт:
Na2[Kat] + Ca(HCO3)2 Û Ca[Kat] + 2NaHCO3 ; (4.85)
Na2[Kat] + MgSO4 Û Mg[Kat] + 2Na2SO4 . (4.86)
Н-катіоніт для зм’якшення води використовують значно рідше, бо внаслідок іонного обміну відбувається підкислення води
Н2[Kat] + CaСl2 Û Ca[Kat] + 2НCl ; (4.87)
H2[Kat] + MgSO4 Û Mg[Kat] + 2H2SO4 . (4.88)
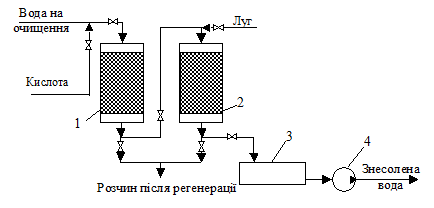
Рис. 4.34. Схема установки для знесолювання води іонітами та її дегазації:
1– катіонітний фільтр; 2 – аніонітний фільтр; 3 – збірник води; 4 – насос
Реакції іонного обміну є оборотними, що використовується для відновлення обмінної здатності іонітів, тобто для їх регенерації. Регенерацію відпрацьованих Na-катіоніту проводять розчином натрію хлориду, а Н-катіоніту – розчинами мінеральних кислот.
Повне знесолювання води здійснюють за допомогою Н-катіоніту та ОН-аніоніту (рис. 4.34).
Спочатку воду подають у катіонообмінний фільтр, де з неї вилучаються катіони Са2+, Mg2+, Na+, K+, NH4+ та інші, а внаслідок іонного обміну утворюється кислота
H2[Kat] + MgСl2 Û Mg[Kat] + 2HCl . (4.89 )
Потім вода проходить через аніонообмінний фільтр, заповнений ОН-аніонітом, де відбувається нейтралізація води внаслідок обміну відповідних йонів:
[An]OH + HCl Û [An]Cl + H2O. (4.90)
Регенерацію відпрацьованого катіоніту здійснюють слабкими водними розчинами кислот, наприклад сульфатної, а аніоніту – лугу, зокрема, їдкого натру
Mg[kat] + 2HCl Û H2[kat] +MgCl2; (4.91)
[An]Cl + NaOH Û [An]OH + NaCl. (4.92)
4.5.2.3.2. Дистиляція води.Дистиляція полягає у вилученні із води усіх розчинених речовин. Її здійснюють лише фізичними методами: термічним і мембранним.
Термічний метод полягає у випаровуванні води з подальшою конденсацією пари – відбувається дистиляція води, яка забезпечує глибоке очищення від усіх розчинених речовин.
Мембранна дистиляція відбувається внаслідок градієнта температур з обох боків мембрани, причому температура вхідного потоку є вищою (50...80 оС), а фільтрату нижчою (20...25 оС), отже, рушійною силою процесу є різниця парціального тиску пари води.
Дегазація води
Дегазацією називають процес вилучення із води розчинених газів. Найчастіше з води усувають вуглецю (ІV) оксид, кисень. В окремих випадках вилучають сірководень, метан та інші розчинені гази.
Суть методу дегазації полягає у зменшенні розчинності у воді газів або їх хімічному перетворенні в неагресивні чи нетоксичні сполуки. Найчастіше застосовують фізичні та хімічні методи дегазації.
До фізичних методів, застосуванням яких досягається зменшення розчинності газу, належать десорбція віддуванням, термічні, вакуумні та комбіновані. У деяких випадках застосовується десорбція витісненням.
Десорбція віддуванням полягає в тому, що через воду барботують газ, який не містить тієї речовини, яку вилучають (наприклад, для десорбції сірководню застосовують повітря, а кисню – азот). Парціальний тиск газу, який вилучають, у газі, що барботує, дорівнює нулю. Унаслідок цього створюється різниця парціальних тисків – виникає рушійна сила десорбції, відтак розчинений у воді газ переходить у бульбашку газу, який барботує через воду і виводиться із її об’єму рідини.
Термічна дегазація ґрунтується на зменшенні розчинності газів за підвищених температур. Цей метод дуже широко використовується у практиці, але якщо вода містить деякі агресивні гази, наприклад, кисень, сірководень тощо, то одночасно із десорбцією інтенсифікуватимуться корозійні процеси.
Вищими за інтенсивністю процесу та ефективністю, порівняно із термічним і особливо десорбцією віддуванням, характеризується вакуумний метод. При зменшенні тиску над рідиною пропорційно зменшується парціальний тиск розчиненої речовини, що зумовлює виникнення різниці парціальних тисків, тобто збільшення рушійної сили процесу. Газова фаза, яка евакуюється з простору над рідиною, є концентрованою за десорбованою речовиною і містить незначну кількість водяної пари. Це зумовлює простоту подальшого технолоґічного перероблення виділеної сполуки.
Комбіновані методи передбачають здійснення дегазації за одночасного підвищення темпатури та зменшення тиску. У цьому випадку застосування вакууму сприяє зменшенню температури кипіння води, внаслідок чого зростає парціальний тиск її пари над рідиною. При цьому відбувається інтенсивніше й повніше вилучення розчинених газів й досягається глибока дегазація води.
Витіснювальна десорбція застосовується за необхідності вилучення із води розчинених газів без підвищення температури чи зменшення тиску, наприклад, під час здійснення технолоґічного процесу. Вона полягає в тому, що через воду барботують такий газ, за присутності якого різко зменшуються розчинності інших газів. Наприклад, аргон витіснює розчинений у воді кисень.
Хімічні методи дегазації ґрунтуються на взаємодії розчинених газів із спеціально підібраними і введеними у воду реаґентами, внаслідок чого утворюються нетоксичні, неагресивні конденсовані речовини.
Для усунення розчиненого кисню застосовують реаґенти з відновними властивостями. Найчастіше використовують залізну (стальну) стружку, натрію сульфіт та тіосульфат, гідразин і, значно рідше, – сірки (IV) оксид. Під час взаємодії розчиненого кисню з натрію сульфітом утворюється нешкідливий сульфат
О2 + 2Na2SO3 = 2Na2SO4. (4.93)
Якщо воду оброблюють сірки (IV) оксидом, то утворюється сульфатна кислота
SO2 + H2O + 0,5О2 = H2SO4 . (4.94)
Унаслідок цього кислотність води зростає, що переважно є явищем небажаним.
Гідразин застосовують у вигляді гідразин-гідрату або гідразин сульфату, наприклад
О2 + N2H4×H2O = N2 + 3H2O. (4.95)
Реакція із задовільною швидкістю відбувається за підвищених температур та у присутності каталізатора.
Перспективними вважаються методи вилучення кисню за допомогою редокс-іонітів – іонообміних смол, які містять групи типу гідрохінону, пірогалолу, пірокатехіну тощо, які мають відновну здатність. Наприклад, гідрохінон окиснюється розчиненим киснем до хінону
2С6Н4(ОН)2 + О2 = 2С6Н4О2 + 2Н2О. (4.96)
Хімічне вилучення кисню зазвичай здійснюють після попередньої фізичної дегазації води.
Сірководень, який характеризується відновними властивостями, видаляють за допомогою речовин, які володіють окисною здатністю: сірки (IV) оксиду, хлору, кисню, озону, калію перманганату. Відповідні окисно-відновні процеси ілюструються такими сумарними реакціями:
2H2S + SO2 = 3S + 2H2O; (4.97)
H2S + Cl2 = S + 2HCl; (4.98)
2H2S + O2 = 2S + 2H2O; (4.99)
3H2S + O3 = 3S + 3H2O; (4.100)
3H2S + 4O3 = 3H2SO4; (4.101)
3H2S + 2KMnO4 = 3S + 2MnO2 + 2КОН + 2H2O. (4.102)
Очищення води від сірководню здійснюють також за допомогою речовин, які утворюють малорозчинні сульфіди:
2Fe(OH)3 + 3H2S = Fe2S3 + 6H2O. (4.103)
Видалення сірководню біохімічним методом відбувається внаслідок життєдіяльності сіркобактерій, для яких цей газ є поживною речовиною; цей процес описується рівнянням (4.98).
Нейтралізація води
