Тепловой эффект растворения
Процесс образования раствора – растворение – заключается в разрушении взаимодействия между молекулами индивидуальных веществ и образовании новых межмолекулярных связей между компонентами раствора.
Количество теплоты, поглощающейся или выделяющейся при растворении одного моля вещества в избытке растворителя, называется теплотой растворения этого вещества.
Образование раствора – процесс самопроизвольный, сопровождающийся уменьшением свободной энергии Гиббса (DGораст):
| DGораст =DHораст –TDSораст < 0. | (5.1) |
Знак изменения энтропии растворения (DSораст) зависит от степени изменения порядка в системе до и после растворения. При растворении газов в жидкости энтропия системы уменьшается, а энтальпия увеличивается, поэтому растворение газов понижается при повышении температуры.
Знак изменения энтальпии системы при растворении (DНораст) определяется суммой тепловых эффектов всех процессов, сопровождающих растворение. При растворении твердого вещества разрушается его кристаллическая решетка и частицы вещества равномерно распределяются по всему объему раствора. Этот процесс требует затраты энергии, следовательно, DНокр > 0. Одновременно протекает процесс взаимодействия частиц растворенного вещества с водой с образованием гидратов, сопровождающийся выделением теплоты (DНогидр< 0).
Общий тепловой эффект растворения твердого вещества (DНораст) определяется соотношением тепловых эффектов этих процессов и может быть как положительным, так и отрицательным, либо равным нулю, как при растворении сахара в воде.
Растворение жидкостей и газов в большинстве случаев сопровождается выделением небольшого количества теплоты и, согласно принципу Ле Шателье, с понижением температуры их растворимость уменьшается.
Растворимость
При приготовлении раствора какого-либо вещества молекулы растворяемого вещества непрерывно переходят в раствор и благодаря диффузии равномерно распределяются по всему объему растворителя. Перешедшие в раствор молекулы растворенного вещества, ударяясь о поверхность еще не растворившегося вещества, снова входят в его состав. По мере возрастания концентрации раствора увеличивается скорость образования твердого вещества. При равенстве скоростей этих процессов в системе устанавливается равновесие (DGораст=0):
вещество нерастворенное « вещество в растворе,
при этом число молекул растворенного вещества, поступающих в раствор и уходящих из него в единицу времени становится равным.
Раствор максимальной концентрации, который при данной температуре может неопределенно долго находиться в равновесии с избытком растворяемого вещества,называется насыщенным.
Концентрация насыщенного раствора называется растворимостью.
Растворимость выражается количеством граммов растворенного вещества, содержащихся в 100 граммах растворителя, либо количеством молей растворенного вещества, содержащихся в 1 литре раствора.
Раствор, концентрация которого при данной температуре меньше насыщенного, называется ненасыщенным.
Растворимость твердых веществ (например, солей), как правило, с понижением температурыуменьшается. Если медленно охлаждать насыщенный раствор, то можно получить пересыщенный раствор, т.е. раствор, концентрация которого больше растворимости вещества при данной температуре. Пересыщенные растворы неустойчивы (DGораст>0) и самопроизвольно или при внешнем воздействии (встряхивание, внесение кристаллов) переходят в состояние равновесия (DGораст=0). При этом избыток растворенного вещества выпадает в осадок.
Концентрация растворов
Концентрацией раствораназывается количество растворенного вещества, содержащееся в определенном количестве или в определенном объеме раствора или растворителя.
В химии наиболее употребимы следующие способы выражения концентрации.
Процентная концентрация. Показывает число граммов растворенного вещества, содержащихся в 100 г раствора. Например, 15%-ный водный раствор соли – это такой раствор, в 100 г которого содержится 15 г соли и 85 г воды.
Молярная концентрация (молярность). Показывает число молей растворенного вещества, содержащихся в 1 л раствора, обозначается моль/л или формулой вещества, заключенной в квадратные скобки. Например, [NaOH]=2 моль/л – это раствор, содержащий 2 моля (или 80 г) гидроксида натрия в одном литре раствора.
Молярная концентрация эквивалентов.Показывает число молей эквивалентов растворенного вещества, содержащихся в 1 л раствора, обозначается Сэк. Например, Сэк H2SO4=0,1моль экв/л – это раствор Н2SO4 , содержащий 0,1 моля эквивалентов серной кислоты (или 4,9 г) в 1 л раствора.
Эквивалентом(обозначается буквой Э) называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквивалент кислотыравен молярной массе кислоты, деленной на ее основность, т.е. на число атомов водорода в молекуле кислоты, способных замещаться на металл.
Эквивалент основанияравен молярной массе основания, деленной на валентность металла.
Эквивалент оксидаравен молярной массе оксида, деленной на произведение числа атомов элемента, входящих в состав молекулы, и валентности этого элемента.
Эквивалент соли равен молярной массе соли, деленной на произведение валентности металла и числа атомов металла в ее молекуле.
Например:
моль экв. Н2SO4 (М=98 г/моль) равен 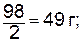
моль экв. Са(ОН)2 (М=74 г/моль) равен 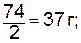
моль экв. Al2O3 (М=102 г/моль) равен 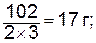
моль экв. Al2(SO4)3 (М=342 г/моль) равен 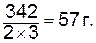
Растворы с молярной концентрацией эквивалентов широко применяются при проведении реакций между растворенными веществами. Пользуясь этой концентрацией, легко заранее рассчитать, в каких объемных соотношениях должны быть смешаны растворенные вещества, для того чтобы они прореагировали без остатка. Согласно закону эквивалентов количества веществ, вступающих в реакцию, пропорциональны их эквивалентам:
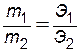 .
.
Следовательно, для реакции всегда нужно брать такие объемы растворов, которые содержали бы одинаковое число молей эквивалентов растворенных веществ. При одинаковой молярной концентрации растворов объемы реагирующих веществ пропорциональны их Сэк. Если объемы затрачиваемых на реакцию растворов обозначить через V1 и V2 , а их молярные концентрации эквивалентов через Сэк.1 и Сэк.2, то зависимость между этими величинами выразится отношением:
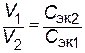 | или 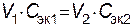 , , | (5.2) |
т.е. объемы реагирующих веществ обратно пропорциональны молярным концентрациям их эквивалентов.
На основании этих зависимостей можно не только вычислить необходимые для проведения реакций объемы растворов, но и по объемам затраченных на реакцию растворов находить их концентрации.
Титр. Показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора. Обозначается буквой Т.
Зная титр раствора, легко вычислить его молярную концентрацию эквивалента, и наоборот:
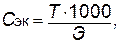
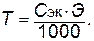
Моляльная концентрация (моляльность). Показывает число молей растворенного вещества, содержащееся в 1000 г растворителя, обозначается Сm :
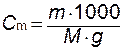 , , |  (5.3) (5.3) |
где m – количество растворенного вещества, 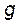 – количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
– количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
Законы Рауля
Каждой жидкости при данной температуре соответствует определенное давление насыщенного пара р0. С повышением температуры р0 увеличивается. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара растворителя над раствором становится ниже, чем над чистым растворителем при той же температуре. Причем понижение давления пропорционально концентрации раствора.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (закон Рауля):
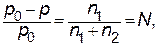 | (5.4) |
где p0– давление насыщенного пара над чистым растворителем;
p – давление насыщенного пара растворителя над раствором; N – мольная доля растворенного вещества; n1 – число молей растворенного вещества; n2 – число молей растворителя.
Мольная доля (Ni) равна отношению числа молей данного вещества (ni) к сумме числа молей всех веществ (включая растворитель) в растворе:
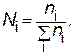
Понижение давления насыщенного пара растворителя над раствором нелетучего вещества приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой.
Температура кипения жидкости Ткип – это температура, при которой давление насыщенного пара ее достигает атмосферного давления; для воды это 100°С (при давлении 101,3 кПа или 1,013∙105 Н/м2). Так как над раствором давление насыщенного пара растворителя ниже, то для того чтобы раствор закипел, его надо нагреть до более высокой температуры, чем чистый растворитель.
Следствия закона Рауля
1. Понижение температуры замерзания DТзам и повышение температуры кипения DТкип раствора неэлектролита прямо пропорциональны количеству вещества, растворенному в данном количестве растворителя.
2. Эквимолярные (т.е. содержащие одно и то же число молей эквивалентов вещества) количества растворенных веществ, будучи растворены в одном и том же количестве данного растворителя, одинаково понижают температуру его замерзания и одинаково повышают температуру его кипения.
Понижение температуры замерзания, вызываемое растворением одного моля вещества в 1000 г растворителя, есть величина постоянная для данного растворителя. Она называется криоскопической константой Kк растворителя. Точно так же и повышение температуры кипения, вызываемое растворением одного моля вещества в 1000 г растворителя, называется эбулиоскопической константой Kэ растворителя. Криоскопическая и эбулиоскопическая константы зависят только от природы растворителя.
Понижение температуры замерзания и повышение температуры кипения разбавленных растворов неэлектролитов пропорционально их моляльной концентрации:
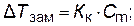 | 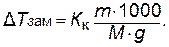 | (5.5) | ||
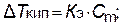 | 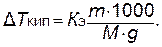 | (5.6) | ||
Приведенные формулы позволяют рассчитывать составы антифризов – растворов, не замерзающих до определенной температуры.
Исходя из приведенных соотношений очевидно, что при растворении в 1000 г данного растворителя 1 грамм-моля какого-либо неэлектролита DТзам и DТкип раствора будут одинаковыми независимо от природы растворенного вещества и равны:
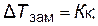 | 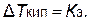 |
Приведенные формулы (5.5, 5.6) дают возможность не только определять температуры кипения и замерзания растворов неэлектролитов по их концентрациям, а также рассчитывать молекулярную массу растворенного вещества по температуре кипения или замерзания его растворов:
