О-Алкилирование(получение простых эфиров)
В качестве алкилирующих агентовгидроксигруппы могут быть использованы алкил(арил)галогениды, непредельные соединения, спирты, эфиры серной и сульфокислот.
Алкил(арил)галогенидышироко применяются для О-алкилирования (арилирования). При этом используется реакция Вильямсонаили реакция гидроксисоединений с галогенидами в присутствии щелочей:
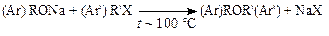
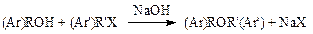
Большой интерес представляют доступные и дешевые метил- и этилхлориды. Алкилирование ими ведут в автоклавах под давлением, поскольку эти вещества имеют низкую температуру кипения.
Так, метилирование гидрохинона проходит при нагревании водного раствора его натриевой соли с хлористым метилом при температуре 100 °С и давлении 2 МПа:
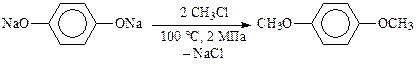
Галогениды часто бывают сложными соединениями, а в ряде случаев их структура сложнее гидроксисоединения.
Примерами О-алкилирования (арилирования) могут быть:
· Алкилирование фенола при получении нафтамона проводят 1,2-дибромэтаном в водно-щелочной среде при кипении реакционной массы:
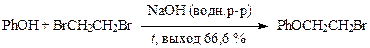
· При получении димедрола бензгидрол алкилируют β-диметиламиноэтилхлоридом при 80 °С в щелочной среде:
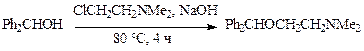
· п-Хлорфеноксиуксусную кислоту (в производстве ацефена) синтезируют из п-хлорфенола и хлоруксусной кислотой в щелочной среде:
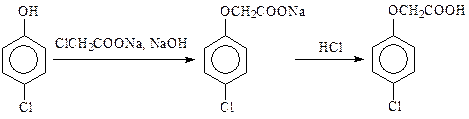
· В производстве витамина В6 метиловый эфир метоксиуксусной кислоты получают, смешивая растворы метилата натрия (субстрата) и хлоруксусной кислоты (алкилирующего агента) в абсолютном метиловом спирте. В дальнейшем к реакционной массе добавляют концентрированную серную кислоту, кипятят 2 часа и отгоняют метиловый спирт. Выход продукта 70 %. При этом в реакциях алкилирования и ацилирования реагент сложнее, чем субстрат.
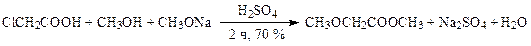
О-Алкилирование может быть использовано для временной защиты гидроксильных групп в гидроксилсодержащих соединениях. Одним из наиболее распространенных способов защиты является метод тритилирования — образование трифенилметиловых (тритильных) эфиров. Чаще всего он применяется в синтезе сахаров, нуклеозидов и глицеридов.
Тритилгалогенид очень объемистая молекула, что значительно затрудняет его реакции с вторичными и третичными спиртами, поэтому метод тритилирования является эффективным способом блокирования первичных гидроксильных групп.
Реакцию проводят, нагревая спирт с рассчитанным количеством тритилхлорида в пиридине. С первичными спиртами она завершается за 1 час при 100 °С.
Тритиловые эфиры, как правило, легко кристаллизуются и обладают гидрофобностью, растворяясь в большинстве апротонных органических растворителей. Они устойчивы к действию щелочей и других нуклеофильных агентов, но гидролизуются в кислой среде. «Снимают» тритильную защиту, как правило, кипячением в 80 %-ой уксусной кислоте.
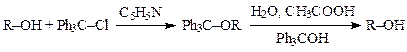
Таким образом, например, можно защитить первичные гидроксилы глицерина получив моно- и дитритиловые эфиры
Непредельные соединениядля О-алкилирования используются реже. Так, при получении β-этоксипропионитрила (в синтезе витамина В1) используют акрилонитрил:
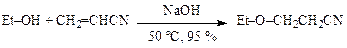
Процесс можно осуществлять также в пленочном реакторе непрерывного действия в присутствии 0,5—1 %-ного раствора этилата натрия.
Эту реакцию используют для модификации углеводов, например, в синтезе карбоксиэтил, карбамоилэтил и др. производных полисахаридов, где помимо акрилонитрила применяют акриламид:
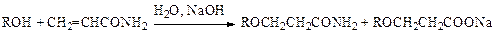
О-Алкилирование спиртамив присутствии минеральной кислоты используется довольно редко и применяется, главным образом, для получения симметричных диалкиловых эфиров и алкоксипроизводных нафталинового и антраценового ряда.
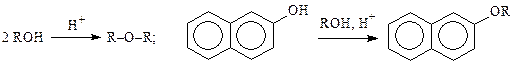
О-Алкилирование эфирами серной кислоты и ароматических сульфокислотимеет значительно большее значение.
Реакция метилирования спиртов и фенолов диметилсульфатом в щелочной среде, также как и в случае аминов, протекает в двестадии. Щелочь повышает нуклеофильность субстрата и нейтрализует выделяющуюся кислоту:
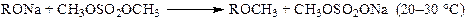

Первая стадия идет легко при температуре ниже 50 °С, вторая — в гораздо более жестких условиях (примерно 100 °С) и часто проводится в автоклаве под небольшим давлением.
При метилировании неустойчивых природных соединений обычно используют лишь одну метильную группу диметилсульфата.
При метилировании фенолов при 100 °С метильные группы диметилсульфата используются примерно на 90 %, как, например, при алкилировании о-нитро-п-крезола:
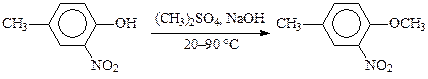
Метилирование пирокатехина диметилсульфатом (в производстве папаверина) проводят в водном растворе NaOH при 18—20 °С с последующей выдержкой при 90—92 °С:
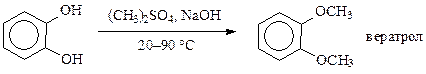
Этим же способом можно метилировать одно- и многоатомные спирты, полисахариды.
Недостатком метода является токсичность диметилсульфата и неполное использование метильных групп.
Алкилирование фенолов эфирами ароматических сульфокислот протекает гладко при кипячении с обратным холодильником смеси фенолята и соответствующего эфира аренсульфокислоты. В качестве растворителя используют полихлорбензол:

