Скорость химических процессов
Для полного описания химической реакции необходимо знать не только принципиальную возможность ее осуществления (решается термодинамически), но и закономерности протекания во времени, т.е. ее скорость и механизм.
Химические реакции могут проходить в гомогенных и гетерогенных системах. Гомогенной называют систему, однородную по составу и свойствам. Гетерогенной называют систему, состоящую из двух или более однородных частей, отделенных друг от друга поверхностью раздела.
Скорость гомогенной химической реакции определяется изменением кон-центрации одного из исходных веществ или продуктов реакции в единицу времени при неизменном объеме системы.
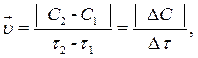
где 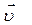 – скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
– скорость химической реакции, моль/(л×с); C1 – первоначальная концентрация вещества (в момент времени τ1), моль/л; C2 – концентрация вещества в момент времени τ2 > τ1, моль/л; ΔС – изменение концентрации вещества за время Δτ = τ2 – τ1; τ1,– исходный момент времени, с; τ2 – текущий момент времени, с; (τ2 > τ1).
В гетерогенных системах реакции идут на поверхности раздела отдель- ных частей системы. Скорость гетерогенной реакции определяют изменением количества вещества, вступившего в реакцию или образующегося в реакции в единицу времени на единице поверхности.
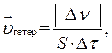
где 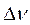 – изменение количества вещества, моль за промежуток времени Δτ, с;
– изменение количества вещества, моль за промежуток времени Δτ, с;
S – площадь поверхности раздела, м2.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализаторов.
Влияние концентрации реагирующих веществ
Скорость элементарной химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ с учетом стехиометрических коэффициентов (закон действия масс К. Гульдберга и П.Вааге).
Элементарными называют реакции, протекающие в одну стадию. Математическое выражение зависимости скорости реакции от концентрации реагирующих веществ для других реакций получают экспериментально. Это уравнение называется кинетическим.
Например, для реакцииH2 + I2 = 2 HI 



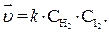
Коэффициент пропорциональности называют константой скорости реакции. Физический смысл k – это скорость реакции при концентрации каждого из реагирующих веществ, равной 1 моль/л.
Влияние температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры (Т) на каждые 10о скорость большинства реакций увеличивается в 2 – 4 раза ( 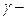 температурный коэффициент):
температурный коэффициент):
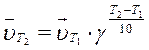
Задания к подразделу 2.2
41.Взаимодействие между оксидом углерода и хлором идет по уравнению
CO (г) + Cl2 (г) D COCl2 (г). Исходная концентрация CO равна 0,3 моль/л, Cl2 – 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию хлора до 0,6, а CO до 1,2 моль/л?
42.На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 81 раз при температурном коэффициенте скорости реакции, равном 3?
43.Константа скорости реакции А + 2В D АВ2 равна 5·10–4 л 2/ (моль2·с). Рассчитайте скорость прямой реакции при СА = 0,6 моль/л и СВ = 0,8 моль/ л.
44.При температуре 773 К реакция протекает в течение 1 секунды. Сколько времени (секунд) потребуется для ее окончания при 673 К, если температурный коэффициент скорости реакции равен 2?
45.Определить, во сколько раз увеличится скорость прямой реакции
2NO (г) + O2 (г) = 2NO2 (г), если концентрацию каждого из исходных веществ (O2, NO) увеличить в 6 раз?
46.Скорость некоторой реакции при уменьшении температуры с 333 до 303 К уменьшилась в 8 раз. Определить температурный коэффициент скорости этой реакции.
47.Во сколько раз увеличится скорость обратной реакции в гомогенной системе 2N2O5 (г) D O2(г) + 2N2O4(г) при увеличении давления в системе в 3 раза?
48.Во сколько раз уменьшится скорость реакции при понижении температуры на 40º, если температурный коэффициент скорости реакции равен 3?
49.Во сколько раз следует увеличить давление в системе, чтобы скорость обратной реакции возросла в 100 раз? Система: С (к) + H2 O (г) D CO (г) + H2 (г)
50.Две реакции при температуре 283 К протекают с одинаковой скоростью ( 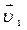 =
= 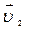 ).Температурный коэффициент скорости первой реакции равен 3, второй равен 4. Как будут относиться скорости реакций (
).Температурный коэффициент скорости первой реакции равен 3, второй равен 4. Как будут относиться скорости реакций ( 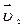 :
: 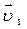 ), если реакцию проводить при 303 К?
), если реакцию проводить при 303 К?
51.Во сколько раз увеличится скорость прямой реакции в гомогенной системе 2N2 (г) + O2 (г) D 2N2O (г) при увеличении давления в два раза?
52.При 273 К реакция заканчивается за один час. Принимая температурный коэффициент скорости реакции равным 3, рассчитайте, сколько минут потребуется на эту же реакцию при 323 К?
53.Взаимодействие между оксидом углерода и хлором происходит по реакции
CO (г) + Cl2 (г) D COCl2 (г). Во сколько раз увеличится скорость прямой реакции при увеличении давления в 4 раза?
54.Скорость некоторой реакции при уменьшении температуры от 333 до 303 К уменьшилась в 27 раз. Определите температурный коэффициент скорости этой реакции.
55.Во сколько раз следует увеличить концентрацию оксида углерода в системе
2CO (г) D CO2 (г) + C(к) , чтобы скорость реакции увеличилась в 16 раз?
56.При увеличении температуры на 40º скорость реакции возросла в 256 раз. Определите температурный коэффициент скорости реакции.
57.Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO (г) + Cl2 (г) D 2NOCl2 (г). Во сколько раз увеличится скорость прямой реакции при увеличении концентрации обоих веществ в два раза?
58.Во сколько раз возрастает скорость некоторой химической реакции при повышении температуры от 298 до 328К, если температурный коэффициент скорости реакции равен 3?
59.Во сколько раз увеличится скорость реакции при повышении температуры на 70º, если температурный коэффициент скорости реакции равен 2?
60.Скорость реакции А + 2В = C при СА = 0,5 моль/л и СВ = 0,6 моль/л равна 1,08 моль/(л·с). Определите константу скорости реакции, л2/(моль2 ·с).
Химическое равновесие
Состояние системы, при которомскорости прямой и обратной реакции равны, называют химическим равновесием. Состояние равновесия характеризуют константой равновесия (Кс).
Гомогенная система:
2SO2 (г) + O2 (г)  2SO3(г)
2SO3(г) 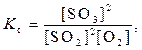
где [ ] – равновесные концентрации веществ.
Гетерогенная система:
Fe2O3 (т) + 3H2 (г)  3 Fe (т) + 3H2O (г)
3 Fe (т) + 3H2O (г) 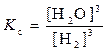 .
.
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твёрдых веществ остаются, как правило, постоянными.
Принцип Ле Шателье. На состояние равновесия системы влияют давление, концентрация реагирующих веществ и температура. Система может находиться в состоянии равновесия бесконечно долго. Если изменить условия его существования, равновесие будет нарушено. Со временем установится новое состояние равновесия, но с другими равновесными концентрациями. Переход из одного равновесного состояния в другое называют смещением равновесия. Качественно определить направление смещения равновесия позволяет принцип Ле Шателье (1884): если находящаяся в истинном равновесии система подвергается внешнему воздействию, равновесие смещается в направлении, которое способствует ослаблению этого воздействия.
 Пример 1. Для реакции N2 (г) + 3H2 (г)
Пример 1. Для реакции N2 (г) + 3H2 (г)  2NH3 (г) при изменении параметров равновесие смещается: 1) с увеличением
2NH3 (г) при изменении параметров равновесие смещается: 1) с увеличением 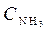
 2) с увеличением Р
2) с увеличением Р
Пример 2. В системе А(г) + 2В(г)  D(г) равновесные концентрации, моль/л: [A] = 0,06; [B] = 0,12; [D] = 0,216. Найти константу равновесия реакции и исходные концентрации веществ А и В.
D(г) равновесные концентрации, моль/л: [A] = 0,06; [B] = 0,12; [D] = 0,216. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением
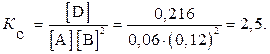
Обозначим исходные концентрации веществ С0, концентрации прореагировавших веществ – Спрор; С0 = Спрор + [ ].
Согласно уравнению реакции
СА прор = [D], СА0 = СА прор + [А] = 0,216 + 0,06 = 0,276 моль/л.
СВ прор =2 [D], СВ0 = СВ прор + [В] =2× 0,216 + 0,12 = 0,552 моль/л.
Задания к подразделу 2.3
61.При синтезе аммиака в равновесии находится 1 моль водорода, 2 моль азота и 8 моль NH3. Во сколько раз исходное количество N2 больше равновесного?
62.В замкнутом сосуде протекает обратимый процесс диссоциации
PCl5 (г)  PCl3 (г) + Cl2 (г). Начальная концентрация PCl5равна 2,4 моль/л. Равновесие установилось после того, как 33,3% PCl5 продиссоциировало. Вычислить равновесные концентрации всех веществ и Кс.
PCl3 (г) + Cl2 (г). Начальная концентрация PCl5равна 2,4 моль/л. Равновесие установилось после того, как 33,3% PCl5 продиссоциировало. Вычислить равновесные концентрации всех веществ и Кс.
63.В сосуде емкостью 1 л при 410 оС смешали 1 моль H2 и 1 моль I2.Вычислить, при каких концентрациях устанавливается химическое равновесие, если константа равновесия равна 48.
64.В сосуде объемом 0,5 л находятся 0,5 моль H2 и 0,5 моль N2. При некоторой температуре к моменту установления равновесия образовалось
0,02 моль NH3. Вычислить константу химического равновесия.
65.В обратимой реакции CO (г) + Cl2 (г)  COCl2 (г) установились следующие равновесные концентрации веществ, моль/л: [CO] = 0,1; [Cl2] = 0,4; [COCl2] = 4. Вычислить Кравн и исходные концентрации Cl2 и CO.
COCl2 (г) установились следующие равновесные концентрации веществ, моль/л: [CO] = 0,1; [Cl2] = 0,4; [COCl2] = 4. Вычислить Кравн и исходные концентрации Cl2 и CO.
66.Определить объемный состав смеси в момент равновесия для системы
Cграфит + O2 (г)  CO2 (г), если при 1300 оС Кс = 0,289.
CO2 (г), если при 1300 оС Кс = 0,289.
67.Равновесие в системе CO(г) + H2O(г)  H2(г) + CO2(г) установилось при следу-ющих концентрациях веществ, моль/л: [CO] = 0,04; [H2O] = 0,08; [CO2] = 0,08. Вычислить Кc и начальные концентрации CO и H2O.
H2(г) + CO2(г) установилось при следу-ющих концентрациях веществ, моль/л: [CO] = 0,04; [H2O] = 0,08; [CO2] = 0,08. Вычислить Кc и начальные концентрации CO и H2O.
68.Константа равновесия системы 2N2 (г) + O2 (г)  2N2O (г) равна 1,21. Равновесные концентрации, моль/л: [N2] = 0,72; [N2O] = 0,84. Рассчитать исходную и равновесную концентрации кислорода.
2N2O (г) равна 1,21. Равновесные концентрации, моль/л: [N2] = 0,72; [N2O] = 0,84. Рассчитать исходную и равновесную концентрации кислорода.
69.Равновесие в системе CO (г) + H2O (г)  H2 (г) + CO2 (г) установилось при сле-дующих концентрациях веществ, моль/л: [CO] = 1; [H2O] = 4; [H2] = [CO2] = 2. Вычислить равновесные концентрации, которые установились после повышения концентрации CO в три раза. В каком направлении сместится равновесие?
H2 (г) + CO2 (г) установилось при сле-дующих концентрациях веществ, моль/л: [CO] = 1; [H2O] = 4; [H2] = [CO2] = 2. Вычислить равновесные концентрации, которые установились после повышения концентрации CO в три раза. В каком направлении сместится равновесие?
70.Рассчитать константу равновесия реакции CO(г) + Cl2 (г)  COCl2 (г), если исходные концентрации CO и Cl2 составляли 4 моль/л, а равновесная концентрация COCl2 равна 2 моль/л.
COCl2 (г), если исходные концентрации CO и Cl2 составляли 4 моль/л, а равновесная концентрация COCl2 равна 2 моль/л.
71.Равновесие в системе 2CO (г) + O2 (г)  2CO2 (г) установилось при следующих концентрациях веществ, моль/л: [CO] = 1,2; [O2] = 0,1; [CO2] = 4. Вычислить исходную концентрацию CO.
2CO2 (г) установилось при следующих концентрациях веществ, моль/л: [CO] = 1,2; [O2] = 0,1; [CO2] = 4. Вычислить исходную концентрацию CO.
72.Определить направление смещения равновесия при увеличении давления в системе 2CO (г)  2CO2 (г) + С(г). Ответ пояснить.
2CO2 (г) + С(г). Ответ пояснить.
73.Константа равновесия процесса CO (г) + Cl2 (г)  COCl2 (г) при определенных условиях равна 4. Равновесные концентрации веществ составляют, моль/л: [Cl2] = 0,5; [COCl2] = 2. Определить равновесную концентрацию CO.
COCl2 (г) при определенных условиях равна 4. Равновесные концентрации веществ составляют, моль/л: [Cl2] = 0,5; [COCl2] = 2. Определить равновесную концентрацию CO.
74.При каких условиях в равновесной системе N2(г) + 3H2(г)  2NH3(г), DH0298 = – 92,4 кДж можно максимально увеличить выход NH3?
2NH3(г), DH0298 = – 92,4 кДж можно максимально увеличить выход NH3?
75.Исходные концентрации оксида азота (II) и хлора в гомогенной системе 2NO(г) + Cl2(г)  2NOCl (г) составляют соответственно 0,5 и 0,2 моль/л. Вычислить Кс , если к моменту наступления равновесия прореагировало 20% оксида азота (II).
2NOCl (г) составляют соответственно 0,5 и 0,2 моль/л. Вычислить Кс , если к моменту наступления равновесия прореагировало 20% оксида азота (II).
76.Две реакции протекали с такой скоростью, что за единицу времени в первой реакции образовалось 3 г сероводорода, а во второй 10 г йодоводорода. Какая из реакций протекала с большей средней скоростью? Ответ пояснить.
77.В сосуде объемом 2 л смешали газ А (4,5 моль) и газ В (3 моль). Газы А и В реагируют в соответствии с уравнением А + В = С. Через 20 с в системе образовалось 2 моль газа С. Определить среднюю скорость реакции. Сколько моль газов А и В осталось в системе?
78.Равновесие гомогеннойсистемы 4HCl(г) + O2(г)  2H2O (г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ, моль/л: [H2O] = 0,14; [Сl2] = 0,14; [HCl] = 0,20; [O2] = 0,32. Вычислите исходные концентрации хлористого водорода и кислорода.
2H2O (г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ, моль/л: [H2O] = 0,14; [Сl2] = 0,14; [HCl] = 0,20; [O2] = 0,32. Вычислите исходные концентрации хлористого водорода и кислорода.
79.Вычислите константу равновесия для системы CO(г) + H2O(г)  СO2(г) + H2 (г),
СO2(г) + H2 (г),
если равновесные концентрации веществ, моль/л: [CO] = 0,004; [H2O] = 0,084; [CO2] = 0,016; [H2] = 0,016.
80.Константа равновесия гомогенной системы CO(г) + H2O(г)  СO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реаги-рующих веществ, если исходные концентрации, моль/л: СCO = 0,10; СH2O= 0,40.
СO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реаги-рующих веществ, если исходные концентрации, моль/л: СCO = 0,10; СH2O= 0,40.
Задания 81-100. Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций и укажите направление смещения равновесия при изменении условий:
а) уменьшении парциального давления одного из исходных газообразных веществ; б) понижении давления; в) повышении температуры.
| Номер задания | Уравнение реакции | DН0, кДж/моль |
2N2O (г) + O2 (г)  4NO (г) 4NO (г) | ||
4NH3(г) + 5 O2 (г)  4NO (г) + 6 H2O (г) 4NO (г) + 6 H2O (г) | ||
2H2S (г) + 3 O2 (г)  2 SO2 (г) + 2 H2O (г) 2 SO2 (г) + 2 H2O (г) | ||
CO2 (г) + H2 (г)  CO(г) + H2O(г) CO(г) + H2O(г) | ||
2 H2 (г) + O2 (г)  2 H2O (г) 2 H2O (г) | – 484 | |
2 SO2 (г) + O2(г)  2SO3(г) 2SO3(г) | – 196 | |
2NO (г) + O2 (г)  2 NO2 (г) 2 NO2 (г) | – 112 | |
Fe3O4 (т) + H2 (г)  3 FeO (т) + H2O (г) 3 FeO (т) + H2O (г) | ||
FeO (т) + H2 (г)  Fe (т) + H2O (г) Fe (т) + H2O (г) | – 272 | |
C( графит) + H2O (г)  CO (г) + H2 (г) CO (г) + H2 (г) | ||
CO (г) + H2O (г)  CO2 (г) + H2(г) CO2 (г) + H2(г) | – 41 | |
SO3 (г) + H2 (г)  SO2 (г) + H2O (г) SO2 (г) + H2O (г) | – 144 | |
H2 (г) + Cl2 (г)  2HCl (г) 2HCl (г) | – 184 | |
FeO (т) + CO (г)  Fe (т) + CO2 (г) Fe (т) + CO2 (г) | – 11 | |
2ZnS (т) + 3 O2 (г)  2 ZnO (т) + 2SO2 (г) 2 ZnO (т) + 2SO2 (г) | – 878 | |
N2 (г) + 3 H2 (г)  2 NH3 (г) 2 NH3 (г) | – 92 | |
СaCO3 (т)  СaO (т) + CO2 (г) СaO (т) + CO2 (г) | ||
2 MgCl2 (т) + 2 O2 (г)  2 MgO (т) + 2 Cl2 (г) 2 MgO (т) + 2 Cl2 (г) | ||
Сa(OH)2 (т)  CaO (т) + H2O (г) CaO (т) + H2O (г) | ||
H2O (г) + CO (г)  CO2 (г) + H2 (г) CO2 (г) + H2 (г) | – 41 |
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Концентрация растворов
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворовназывают определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них (табл.3.1).
Таблица 3.1
| Методы выражения концентрации растворов | Обозначение и размерность применяемых величин |
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора: 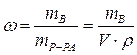 | 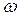 - массовая доля растворенного вещества, безразмерная величина - массовая доля растворенного вещества, безразмерная величина |
| mВ - масса растворенного вещества, г | |
| mР-РА - масса раствора, г | |
| V - объем раствора, мл | |
| ρ -плотность раствора, г/мл | |
Процентная концентрация: 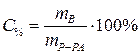 | С% - процентная концентрация, % |
| m В - масса растворенного вещества, г | |
| mР-РА - масса раствора, г | |
Молярная концентрация, или молярность,– число молей растворенного вещества в 1 дм3 (1 литр) раствора: 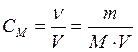 | СМ - молярная концентрация , или молярность; иногда обозначают М |
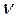 - количество (число моль) растворенного вещества, моль - количество (число моль) растворенного вещества, моль | |
| V - объем раствора, дм3 (л) | |
| mВ - масса растворенного вещества, г | |
| МВ - молярная масса растворенного вещества, г/моль |
Для более рационального решения предложенных задач можно применять вспомогательные формулы (табл.3.2).
Таблица 3.2
| Формула | Применение |
| mР-РА = V·ρ | Для вычисления массы раствора |
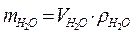 | Для воды 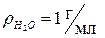 при 4 оС (1мл = 1 см3) при 4 оС (1мл = 1 см3) |
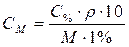 | Для перехода от процентной к молярной концентрации |
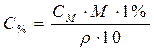 | Для перехода от молярной к процентной концентрации |
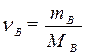 | Для нахождения количества вещества |
| m1Р-РА+ m2Р-РА= mР-РА | При сливании двух растворов различных концентраций массы первого и второго растворов складываются |
| m1В+ m2В= mВ | При сливании двух растворов различных концентраций массы растворенных веществ, содержащихся в растворах, складываются |
| m1В= m2В | При разбавлении растворов водой масса вещества, содержащегося в растворе, остается неизменной |
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин. Решение задач оформлять обязательнов соответствии с приведенными ниже примерами.
