Методы количественного определения аналитов
Потенциометрические методы количественного определения подразделяют на прямую потенциометрию, называемую также ионометрией, если используют ионселективные электроды, и потенциометрическое титрование.
Прямая потенциометрия
В прямой потенциометрии индикаторный электрод и электрод сравнения, как правило, помещают в раздельные части ячейки, соединенные солевым мостиком. Непосредственное вычисление концентрации по уравнению Нернста по измеренному значению потенциала приводит к большим погрешностям из-за неизвестной величины диффузионного потенциала, возникающего на границах раздела жидкостных соединений. Поэтому прямую потенциометрию применяют, главным образом, в двух следующих вариантах.
Метод градуировочного графика. Сущность этого метода состоит в следующем. Приготавливают серию стандартных растворов с известными концентрациями аналита, во все растворы вводят избыток индифферентного фонового электролита и измеряют значения потенциала электрода для каждого раствора. По полученным данным строят линейный градуировочный график Е=f(с). Затем при тех же условиях и при том же избытке фонового электролита измеряют потенциалы электрода в анализируемых растврах и по градуировочному графику находят их концентрации.
Метод добавок. Этот метод является оптимальным, особенно при анализе растворов сложного (и не всегда известного) состава. При осуществлении метода добавок сначала измеряют потенциал Ех анализируемого раствора с неизвестной концентрацией сх. Затем при тех же условиях готовят анализируемый раствор с известной добавкой аналита (сх+сд) и измеряют потенциал электрода (Ех+д) в растворе с добавкой. Разность измеренных значений потенциалов Ех+д и Ех дает возможность определить концентрацию сх анализируемого раствора:
 , (4.3)
, (4.3)
где ∆с – прирост концентрации аналита в анализируемом растворе после его добавки. Из уравнения (4.3) получаем расчетное уравнение:
 . (4.4)
. (4.4)
В прямой потенциометрии предпочтительнее использовать ионоселективные индикаторные электроды.
Потенциометрическое титрование
Потенциометрическое титрование является разновидностью титриметрического метода, в котором используется потенциометрическая индикация конечной точки титрования. Потенциометрическое титрование можно проводить компенсационным и некомпенсационным методами. По компенсационному методу во воремя титрования измеряют ЭДС потенциометрической ячейки, а по некомпенсационному – силу тока, протекающего в цепи ячейки, которая практически пропорциональна ЭДС ячейки. Вблизи точки эквивалентности ток резко возрастает, указывая на достижение эквивалентности взаимодействия аналита и титранта.
В компенсационном методе ЭДС ячейки в процессе титрования измеряют путем ее компенсации (т.е. уравнивания с помощью сопротивлений) с нормальным элементом Вестона, имеющим постоянную ЭДС, равную 1.018 В.
Точку эквивалентности при потенциометрическом титровании определяют по построенной кривой титрования. При этом в качестве регистрируемого сигнала (параметра) используют электродный потенциал, ток или даже рН раствора а аналитическим сигналом является эквивалентный объем титранта.
Несмотря на то, что при компенсационном способе измерения ЭДС точность титрования выше, некомпенсационное титрование применяют чаще.
В методе потенциометрического титрования потенциал электрода используется как регистрируемый сигнал, который измеряют после каждой добавки раствора титранта. Эквивалентный объем титранта находят с помощью кривых титрования, которые строят различными способами в зависимости от величины концентрации титруемого раствора.
При титровании сравнительно больших концентраций (~0.1 моль×л–1) эквивалентный объем титранта находят по резкому изменению потенциала в процессе титрования – по скачку интегральной кривой титрования Е=f(V) (рис. 4.3).
| ТЭ |
| VЭ |
| V |
| E |
Рисунок 4.3 – Интегральная кривая потенциометрического титрования
| V |
| VЭ |
| ΔE/ΔV |
Рисунок 4.4 – Дифференциальная кривая потенциометрического титрования
При средних содержаниях титруемого аналита (10–2–10–3 моль×л–1) эквивалентный объем титранта определяют по дифференциальной кривой титрования, построенной в координатах ∆E/∆V=f(V), где ∆E – разность значений потенциала электрода, соответствующая разности объемов добавляемого титранта (рис. 4.4). При титровании разбавленных растворов (10–4–10–5 моль×л–1) применяют метод Грана, основанный на линеаризации ветвей интегральной кривой титрования, лежащих по обе стороны от точки эквивалентности (исключая область вблизи точки эквивалентности). Г.Гран преобразовал функцию, связанную с потенциалом электрода таким образом, что она изменяется линейно по мере добавления титранта. Для определения эквивалентного объема титранта строят линейные кривые титрования в координатах 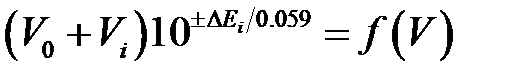 , где V0 – исходный объем титруемого раствора в ячейке; Vi – добавляемый объем титранта; ∆Ei – разность потенциалов между измеряемым значением потенциала Ei и произвольно выбранным постоянным его значением Econst для всей серии измерений. Кривые титрования по методу Грана можно строить и в преобразованных координатах, выраженных в единицах рН:
, где V0 – исходный объем титруемого раствора в ячейке; Vi – добавляемый объем титранта; ∆Ei – разность потенциалов между измеряемым значением потенциала Ei и произвольно выбранным постоянным его значением Econst для всей серии измерений. Кривые титрования по методу Грана можно строить и в преобразованных координатах, выраженных в единицах рН:
со стороны избытка кислоты – 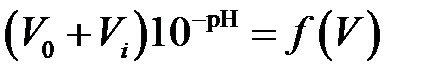 ,
,
со стороны избытка щелочи –  .
.
Однако из-за влияния растворенного в воде СО2 титрование предпочтительно проводить методом добавок за точкой эквивалентности при титровании щелочи или увеличивая неизвестную концентрацию кислоты (отдаляясь от точки эквивалентности). При титровании в кислой области в обоих случаях используют не абсолютное значение рН, а разность между его постоянным значением для всей серии измерений (pHconst≈4.3) и каждым pHi, соответствующим i-ой добавке титранта (кислоты). В этом случае кривую титрования строят в координатах 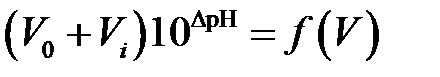 , где ∆рН=pHconst–pHi. Эквивалентный бъем титранта определяют продолжением линейных участков кривой титрования до пересечения с осью объема. При «титровании» кислоты кислотой на отрицательной полуоси объемов находят объем кислоты, соответствующий ее количеству в анализируемом растворе (рис. 4.5).
, где ∆рН=pHconst–pHi. Эквивалентный бъем титранта определяют продолжением линейных участков кривой титрования до пересечения с осью объема. При «титровании» кислоты кислотой на отрицательной полуоси объемов находят объем кислоты, соответствующий ее количеству в анализируемом растворе (рис. 4.5).
 |
| VЭ |
| VЭ |
| VR |
Рисунок 4.5 – Линейные кривые рН-метрического титрования: 1 – титрование раствора соды соляной кислотой за точкой эквивалентности; 2 – титрование сильной кислоты методом добавок той же кислоты
Все виды потенциометрического титрования по точности и воспроизводимости полученных результатов превосходят методы прямой потенциометрии.
