Свойства р-элементов vi группы
Электронные формулы элементов. Степени окисления, валентность. Закономерность в изменении радиусов атомов, энергии ионизации, сродства к электрону в ряду кислород – теллур.
Кислород, лабораторные и промышленные способы получения. Строение молекулы кислорода (методы ВС, МО), свойства кислорода. Объяснение закономерности в изменении величин энергии связи, длины и порядка связи в ряду О2+ – О2 – О2– – О22–.
Озон. Строение молекулы озона с позиций метода ВС, получение, свойства. Озониды, получение, окислительные свойства.
Оксиды, изменение кислотно-основных свойств оксидов в группах и периодах.
Соединения водорода с кислородом. Вода, строение молекулы (метод ВС). Образование межмолекулярных водородных связей, физические свойства воды. Ассоциация и самоионизация воды. Донорные свойства молекул Н2О.
Пероксид водорода, строение молекулы, получение пероксида водорода. Окислительно-восстановительные свойства пероксида водорода в зависимости от среды.
Сера, аллотропные модификации серы, химические свойства (взаимодействие с металлами и неметаллами, кислородом, щелочью, с серной и азотной кислотой).
Соединения серы с водородом: сульфаны, сероводород. Получение сульфанов, строение молекул. Получение сероводорода, строение молекулы (объяснение с позиций метода ВС). Кислотные и восстановительные свойства сероводорода. Изменение температур плавления, кипения, термической устойчивости, а также кислотных и восстановительных свойств в ряду вода –теллуроводород. Сульфиды. Гидролиз сульфидов. Полисульфиды.
Кислородные соединения серы. Термодинамический анализ процессов взаимодействия серы с кислородом, оксида серы (IV) с кислородом. Кислотные свойства, окислительно-восстановительные свойства оксидов, способность SO3 к полимеризации.
Сернистая кислота, кислотные, окислительно-восстановительные свойства сернистой кислоты и сульфитов. Гидролиз сульфитов.
Серная кислота, взаимодействие разбавленной и концентрированной серной кислоты с металлами и неметаллами. Олеум, полисерные кислоты, строение. Получение серной кислоты (контактный и нитрозный способы). Полисерные кислоты, их строение. Тиосерная кислота и тиосульфаты. Строение, устойчивость (взаимодействие тиосульфатов с кислотой, хлором, йодом). Общая формула политионовых кислот, строение. Пероксокислоты серы. Строение, свойства. Пероксосульфаты.
Галогениды серы. Гидролиз галогенидов серы.
Вопросы и задачи: 12,с. 12, № 1–99.
1. Через 100 мл 0,2 н. раствора NaOH пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
(Ответ: NaHSO4; m = 2,08 г)
2. Рассчитать давление разложения в системе [Ag2SO4] ↔ ↔2[Ag] + (SO2) + (O2) при 1000оС.
(Ответ: Рразл. = 3,29 атм.)
3. Давление насыщенного пара бромида калия составляет 0,0013 атм. при 794оС и 0,13 атм. при1137оС. Рассчитать термодинамические характеристики процесса испарения KBr.
(Ответ: DH 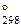 = 168 кДж; DS
= 168 кДж; DS 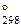 = 102 Дж/.К)
= 102 Дж/.К)
4. 1мл 80%-ной серной кислоты (ρ = 1,727 г/мл) разбавили водой до 2 л. Определить рН полученного раствора.
(Ответ: pH = 1,85)
5. Во сколько раз растворимость CdS в чистой воде выше, чем в 0,01 М растворе сульфида натрия?
(Ответ: в 9 . 1011 раз)
6. Написать молекулярные и ионные уравнения гидролиза: а) сульфита калия; б) сульфата цинка; в) сульфида алюминия. Рассчитать рН 0,1 М раствора сульфита калия.
(Ответ: pH = 10,13)
7. Рассчитать концентрацию ионов серебра в 0,1 М растворе дисульфитоаргентата натрия, если он содержит 0,01 моль/л сульфита натрия.
(Ответ: C = 4,5 . 10–5)
8. Закончить уравнения, составить полуреакции окисления и восстановления. Для а) рассчитать Кс (Т = 298 К):
а) KMnO4+K2SO3+H2O →; б) MnO2+K2SO3+H2SO4 →.
(Ответ: Кс = 4 . 10155)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из медного электрода, опущенного в насыщенный раствор CuS, и водородного электрода, опущенного в раствор, полученный при разбавлении 2 мл 98%-ного раствора серной кислоты водой до 3 л. (Т = 298 К).
(Ответ: DE = 0,118 В)
10. Электролизу подвергается 1М раствор сульфата цинка и сульфата железа (II) (рН=1) на электродах из черненой платины. Определить интервал напряжений, при которых на катоде выделяется железо без выделения цинка.
(Ответ: U = 1,97 – 2,29 В)
Литература: 1, с. 338–373; 2, с. 430–452.
