Реакции гидратации алюмината с участием сульфатов
Для регулирования сроков схватывания цемента при помоле клинкера добавляют 4-5 % гипсового камня. В противном случае будет происходить так называемое «ложное схватывание», когда цементный порошок смешиваете с водой он начинает сразу загустевать и схватываться. По ГОСТ 10178-85 начало схватывания цементного теста должно наступать не ранее 45 минут, конец схватывания должен наступать не позднее 10 часов. Сроки схватывания цемента определяют на приборе Вика.
В качестве регулятора сроков схватывания цемента используют двуводный сульфат кальция CaSO4·2H2O (короткая формула CsHx). Регулятором является в основном дигидрат или полугидрат, или смеси обоих видов сульфата кальция. При помоле клинкера с добавками в трубных шаровых мельницах происходит сильный нагрев цемента, так как затрачиваемая на процесс помола энергия используется непосредственно для измельчения лишь частично. Следовательно, при высокой температуре двуводный гипс полностью или частично может дегидратироваться до полуводного. Общее количество вводимого сульфата и отношение введенного дигидрата и полугидрата должно быть согласовано с реакционной способностью клинкера и требованиями в отношении установления поведения цемента (сроков схватывания). Высокое содержание CaSO4·nH2O задерживает сроки начала и конца схватывания цемента до необходимых пределов. В зависимости от концентрации регулятора схватывания могут иметь место различные реакции: если содержание CaSO4·nH2O высокое то С3А реагирует с водой и CaSO4 с образованием соединения, которое называется "эттрингит" (по названию одноименной местности Ettringen в Эйфеле) (уравнение 19). Так как в одном моле эттрингита связано три моля CaSO4, то его также называют "трисульфат" (трехсульфатная форма гидросульфоалюмината кальция ГСАК-3), или в английской литературе как "AFt - фазы". Если в реакционной смеси в настоящее время есть небольшое количество сульфата, то это может обеспечить низкую скорость растворения и реакция алюмината приводит к образованию "моносульфата" (моносульфатной формы гидросульфоалюмината кальция), который также называют "AFm-фаза" (уравнение 20). Формирование моносульфата может также происходить при местном недостатке сульфата кальция (гипса). В дальнейшем ходе гидратации цемента при увеличении концентрации сульфата кальция содержание кристаллов эттрингита будет увеличиваться. Однако эттрингит устойчив только при концентрациях сульфата кальция > 2,35 мг SO42-/л. При снижении этой концентрации в поровой жидкости цементного камня эттрингит становится неустойчивым; он изменяется (переходит) в соответствии с уравнением 21 при взаимодействии с остаточной С3А и водой в моносульфатную форму. Это означает, что концентрация эттрингита при гидратации проходит через максимум, а затем снова уменьшается; одновременно со снижением концентрация эттрингита происходит увеличение концентрации моносульфата.
Высокая концентрация сульфата:
C3A + 3CsH2 + 26H → C3A·3Cs·H32 Уравнение 19
Эттрингит, AFt-фазы
Низкая концентрация сульфата:
C3A + CsH2 + 10H → C3A·Cs·H12 Уравнение 20
Моносульфат, AFm-фазы
Реакция эттрингита с С3А:
C3A + C3A·3CsH32 + 4H → 3C3A·Cs·H12 Уравнение 21
Моносульфат
Реакция алюмината с сульфатом происходит как в ранее описанной реакции хотя и очень быстро, то есть, в течение нескольких минут. ESEM микрофотографии показывают, однако, то что первоначально образованный "первичный" эттрингит в отличие от С-S-H фазы не занимает поровое пространство. Скорее всего, он формируется в виде компактного, очень короткопризменного эттрингита (до 500 нм), который покрывают поверхность С3А или цементного зерна. Благодаря этой "пассивации" происходит продление срока схватывания цементного теста, в течение которого вы можете обрабатывать строительный материал, приготовить и заформовать бетонное изделие. Пассивация не является постоянной, а поверхность гидратирующих частиц цемента частично проницаема для воды и ионов сульфата. Дальнейший ход и скорость гидратации поэтому контролируется скоростью диффузии. Таким образом, на границе раздела С3А/эттрингит реакция идет медленно (почти полностью затормаживается), на поверхности гидратирующей частицы цемента образуется плотная пленка, которая не пропускает воду внутрь, наступает индукционный период. Дальнейшее образование эттрингита и других гидратов внутри пленки приводит к разрыву пленки на поверхности гидратирующей частицы цемента, вода начинает проникать внутрь, наружу выходят продукты гидратации и происходит интенсивная гидратация клинкерных минералов. Благодаря этому процессу и параллельно происходящей перекристаллизацией эттрингита из длинных кристаллов (волокон) в хорошо оформленные кристаллы эттрингита (длина 2,5 мк), реакция С3А усиливается. На рисунке 1.35 показано, как вместо длинных волокон эттрингита после гидратации в течение 4 час в цементной структуре образуются кристаллы в форме кирпича. Для достижения полной конверсии С3A в эттрингит, количество и растворимость поставляемых сульфатных ионов должно [4, 5, 33, 121] очень точно соответствовать реакционной способности С3А. На практике это случается редко. Часто равновесие между эттрингитом, моносульфатом и гидроксидом кальция нарушается. В зависимости от соотношения С3А/CsH2 гидратными продуктами, перечисленными в таблице 1.21, могут быть.
Таблица 1.21- Ожидаемые продукты гидратации при различных соотношениях C3А/CsH2
| С3А/Cs H2 | Продукт гидратации |
| >3 | эттрингит и свободный гипс |
| 3,0 | эттрингит |
| 1,0... 3,0 | эттрингит и моносульфат |
| 1,0 | моносульфат |
| <1,0 | моносульфат и C4AH13, C2AH8 соответственно С3А(Cs,CH)Н12 |
| C3AH6 |

Рисунок 1.35 - Образование эттрингита при гидратации цемента; Слева: кристаллы эттрингита сформировавшиеся через 2 ч гидратации; справа: удлиненные кристаллы эттрингита (длина 1-2,5 мкм) через 4 ч гидратации в структуре CEM I 32,5R
Временные изменения эттрингита, размер и габитус кристаллов могут быть получены с помощью дополнительных химических агентов [131]. Это имеет большое значение для технологичности раствора или бетона. Изображения с высоким разрешением также показывают, что эттрингит часто образуется полисинтетическим или полым (рисунок 1.36).
При определенных обстоятельствах, при тепловой обработке бетона может образоваться "поздний" эттрингит (англ. "Задержка образования Ettringites"). Их не следует путать с формированием первичного или вторичного эттрингита в пределах нормальной гидратации. Тепловая обработка бетона в процессе твердения и развития прочности должны быть ускорены до распалубки. Если температура превышала 70 °С, то в ходе процесса гидратации может предпочтительно образоваться моносульфатная форма вместо эттрингита. Причиной является низкая термическая стабильность эттрингита. Он легко преобразуется при нагревании, выделяя воду и сульфат в моносульфатном порядке. Часть сульфата не связана, как AFm или AFt кормовой части, но, как правило, включены в C-S-H-фазы. В затвердевшем состоянии моносульфат может затем реагировать с сульфатами, которые были включены в C-S-H-фазы с образованием эттрингита. Эта реакция протекает очень медленно. В отличие от раннего формирования эттрингита в пластическом состоянии, это приводит к образованию позднего эттрингита и расширению объема, которые могут привести к разрушению термообработанного бетона не через несколько месяцев, а, как правило, только после нескольких лет [132].

Рисунок 1.36-Эттрингит, полисинтетическим побратимом (слева) и полые (справа)
1.1.10.3 Гидратация феррита (C4AF)
Гидратация C4AF является одним из сегодняшних наименее понятных процессов в гидратации цемента. Например, непонятно, почему чистый C4AF замечательно взаимодействует с водой в то время как C4AF в составе цемента очень медленно реагирует с водой. Последнее является трудно объяснимым процессом. До сих пор неясно, каким образом железо включено в гидратные продукты. Вот описание двух моделей, которые предлагаются авторами. Первый из них описывает разработанную Тейлором идею гидратации к железистому эттрингиту (AFt = Алюминатферрит - трисульфат) и моносульфат; вторая модель основана на последних результатах исследований по ESEM Ф. А. Фингер - Институт проблем материаловедения в Веймаре. В целом было отмечено, что с увеличением содержания железа в алюмоферрите (как C6AF2 в смешанный кристалл серии C2A .... C2F) гидратация идет медленнее [5, 121, 120, 133].
Модель Тейлора
Однако гидратные продукты C4AF являются кальциевоалюминатноферритными гидратами. Аналоговая гидратация С3А состав зависит от содержания сульфата. При отсутствии носителя сульфата первоначально формируются в соответствии с уравнением 22 кальциевый гидроалюмоферрит как промежуточный продукт и смесь железа и алюминия:
2С4AF + 32H → C4(A,F)H13 + 2С2(A,F) + (A,F)H3 Уравнение 22
Нестабильные промежуточные продукты преобразуются в соответствии с уравнением 23 в кристаллы пластинчатой фазы:
C4(A,F)H13 + 2С2(A,F) → 2C3(A,F)H6 +9H Уравнение 23
В присутствии носителя сульфата в форме железистого эттрингита при гидратации первоначально (Алюминат феррит трисульфат, AFt) и, возможно, позднее (в зависимости от сульфатно-листинга) Алюминат феррит-моносульфат (AFm) протекает реакция:
3C4AF + 12CsH2 + 110H → 4C3(A,F)·3CsH32 + 2(A,F)H3 Уравнение 24
Eisenettringit, Aft
4C3(A,F)·3Cs·H32+3C4AF+12CsH2+14H→4C3(A,F)∙CsH12+2(A,F)H3 Урав-е 25
Алюминатферрит-моносульфат, AFm
Модель Старка
Согласно этой модели, относительно медленная гидратация C4AF объясняется выщелачиванием алюминия из зерен C4AF. Это происходит таким образом, что в растворе алюминат реагирует так же, как чистый С3А с эттрингитом с помощью сульфата и Са(ОН)2. Он сформировал Аl-истощенные и, таким образом, Fe-обогащенные зерна C4AF, которые после долгого времени гидратации были все еще видны в микроструктуре. Так как выщелачивание происходит относительно медленно, сульфат-носитель, как правило, быстро переходит в раствор, это может привести к временному образованию вторичного гипса в микроструктуре затвердевшего цементного теста. Эта штукатурка снова исчезает, как только в дальнейшем сульфат необходим для образования эттрингита выщелоченного алюмината. В результате, гидратация C4AF первоначально приводит к образованию безжелезистого эттрингита, который превращается в моносульфат и вторичный гипс позже. Поддерживается, среди прочего, нами тот факт, что, вопреки идее Тейлора - это не гидроксид железа. Для полного прояснения процессов гидратации C4AF необходимы безусловно дальнейшие исследования.
Гидратация цементов
В процессе гидратации цемента все ранее описанной операции в той или иной степени протекают частично одновременно, но частично и в разное время. Так что мы имеет сложную систему работы с несколькими частично взаимозависимыми индивидуальными реакциями. Во время гидратации содержание фаз клинкера в реакционной смеси уменьшается независимо друг от друга и образуются гидратные фазы, некоторые из которых являются метастабильными и бывают конвертированы в процессе гидратации в термодинамически наиболее стабильные гидратные фазы. Во время процесса гидрации продолжает происходить перекристаллизация гидратов, которая изменяет морфологию продуктов гидратации без дальнейшей реакции. На рисунке 1.37 показано изменение содержания алита, портландита (Ca(OH)2), алюмината и испарение воды из цемента с использованием и без использования гипса в качестве замедлителя сроков схватывания.
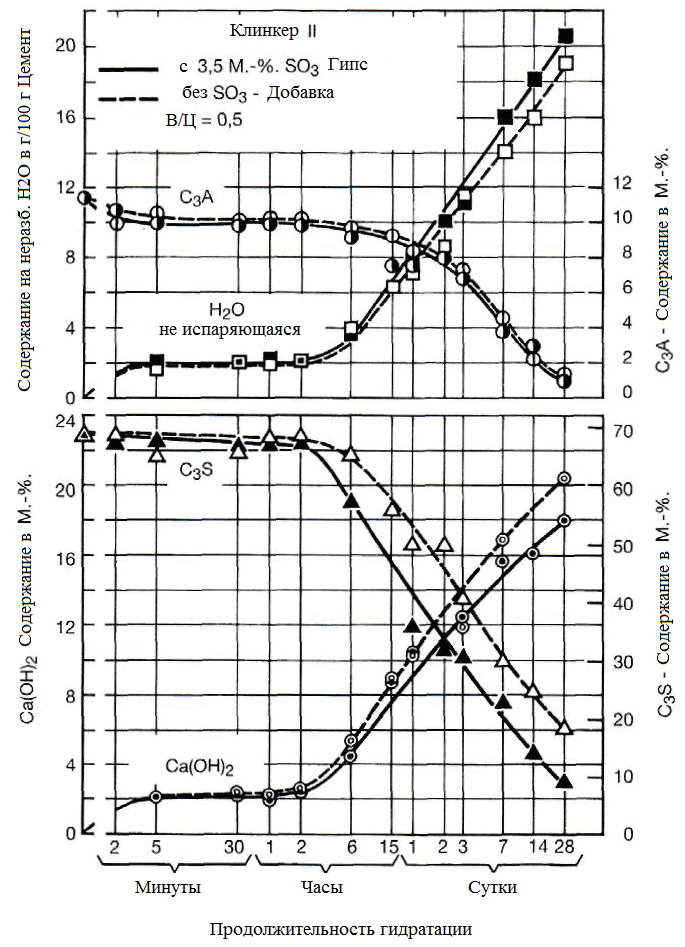
Рисунок 1.37- Изменение содержания алита, портландита (Ca(OH)2), алюмината и испаряющейся воды из цемента [4, 134]
В 1976-1983гг. Лохер, Рихардс и Шпрунг разработали общую модель для гидратации цемента, которая описана ниже. Согласно этой точки зрения (см. рисунок 1.38) сразу после попадания воды вступает в реакцию небольшая часть (около 10%) алюмината, содержащегося в цементе. Гидратация алита начинается с начальной реакции и приблизительно от 1 до 2 мас.% алита реагирует с водой (см. рисунок 1.37). В качестве продуктов первичной реакции силикатов кальция и алюмината, таким образом, являются ограниченное количество гидроксида кальция и эттрингита.
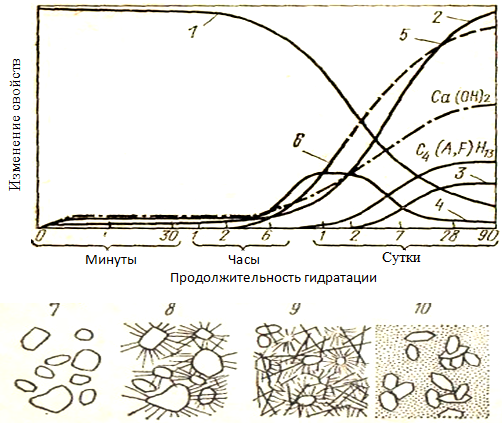
Рисунок 1.38 - Схема последовательности образования гидратных соединений при взаимодействии цемента с водой (по Лохеру, Рихардсу и Шпрунгу) [134]:
1– пористость цементного камня; 2 – прочность цементного камня;
3 – моносульфат кальция; 4 – трисульфат кальция (эттрингит);
5–коротковолокнистые гидросиликаты кальция;
6 - длинноволокнистые гидросиликаты кальция; 7 – пластичное тесто;
8 – схватившаяся масса; 9 – кристаллическая структура прочного камня; 10 – кристаллическая структура камня, содержащего стабильные соединения
После первой интенсивной реакции гидратации наступает индукционный период. В течение последующего периода покоя гидратация затормаживается, тепловыделение почти прекращается, только очень небольшие количества клинкерных фаз алита и алюмината могут прореагировать. Приблизительно по истечении от одного до двух часов могут быть обнаружены C-S-H-фазы. Из алюмината и сульфата кальция образуется эттрингит, первоначально в форме геля и поэтому рентгенографией не обнаруживается, а затем перекристаллизуется в течение нескольких часов, образует хорошо закристаллизованные иглы, которые могут быть обнаружены с помощью дифракции рентгеновских лучей и хорошо видны под электронным микроскопом ESEM. Концентрация C-S-H-фазы затем возрастает в процессе гидратации непрерывно, в результате чего увеличивается концентрация гидроксида кальция, а также уменьшается поровое пространство между гидратными соединениями. Концентрация эттрингита достигает максимума через несколько часов. Падающее (снижающееся) содержание сульфата с другой стороны, приводит к уменьшению концентрации эттрингита; одновременно увеличивается количество моногидросульфоалюмината кальция (ГСАК-1). Гидратация ферритной фазы протекает очень медленно [31, 134, 149].
Увеличение содержания элементов в растворе во времени обусловлено растворением минералов, а снижение их содержания вызывается вступлением их в реакцию друг с другом или с исходным вяжущим с образованием новых водосодержащих соединений – кристаллогидратов.
После достижения пересыщения из раствора кристаллизуются Са(ОН)2 и эттрингит (рисунок 1.38). Гидроксид кальция выделяется в виде тонких гексагональных пластин, способных быстро вырастать до больших размеров. Эттрингит из пересыщенного раствора кристаллизуется в виде коротких призм, а при снижении концентрации раствора до состояния насыщения – в виде удлиненных призматических и игольчатых кристаллов. Образующиеся в растворе кристаллы Са(ОН)2 и эттрингита образуют осадки в виде плотной корки на частичках цемента, обогащенных С3А и C4AF, которые затрудняют диффузию воды к негидратированной их части и замедляют тем самым процесс гидратации. Скорость процесса гидратации (выражаемая скоростью выделения теплоты) зависит от количества введенного сульфата кальция. При небольшом количестве SO3 скорость тепловыделения вначале высока, но на зернах цемента сразу же образуется оболочка из кристаллов эттрингита, тормозящая дальнейшее протекание процесса гидратации. По мере возрастания количества SO3 скорость тепловыделения понижается и растягивается во времени, что связано с образованием и циклическим разрушением оболочек из кристаллов эттрингита на зернах цемента.
Начало образования кристаллов гидросиликатов кальция наблюдается по истечении примерно 1 часа гидратации цемента. Волокнистые кристаллы гидросиликатов кальция участвуют вместе с призматическими кристаллами эттрингита и пластинками Са(ОН)2 в формировании оболочек на зернах цемента. При этом если кристаллы гидросиликатов кальция являются трубчатыми, то они образуют рыхлые участки оболочки, через которые вода диффундирует интенсивнее.
На второй стадии процесса гидратации происходит выделение кристаллов большого числа гидратов.
Период заторможенных реакций (близкий к индукционному) продолжается 1…3 часа или даже более, а затем в результате разрушения оболочек растущими под ними кристаллами эттрингита и портландита процесс образования гидратов и в том числе эттрингита вновь ускоряется.
Через 4…6 часов от начала процесса гидратации наступает стадия ускоренной реакции. По мере накопления новых продуктов реакции разрушенный участок оболочки залечивается и процесс гидратации вновь затормаживается до следующего разрыва оболочки кристаллами эттрингита. Лишь после снижения концентрации ионов SO42- в растворе до равновесной, возможность дальнейшей кристаллизации эттрингита под оболочкой и ее разрыва устраняется.
Полагают, что процесс связывания сульфат-ионов (переходящих в раствор) в эттрингит завершается примерно по истечении 1 суток гидратации. Если при этом весь SO42- вступил в реакцию, а C3AHx еще остался в свободном состоянии, то возможно протекание в небольшом объеме реакции взаимодействия эттрингита с гидроалюминатом кальция с образованием гидросульфоалюмината кальция (моносульфата кальция):
3CaO·Al2O3·3CaSO4·31H2O + 2(3CaO·Al2O3·13H2O) ®
® 3(3CaO·Al2O3·CaSO4·12H2O) + 21H2O
Количество трисульфата кальция в результате этой реакции снижается (см. рисунок 1.38). Возрастает также количество твердого раствора С4(А,F)Н13. Кристаллы гидросиликатов кальция образуются на этой стадии преимущественно в виде длинных волокон, так как развитое поровое пространство позволяет им свободно расти. Одновременно с кристаллами образуется значительное количество тоберморитового геля. В этот период формируется основной кристаллический каркас твердеющего цементного камня (рисунок 1.38).
В период третьей стадии (до 28 суток) гидратации развитие процесса лимитируется скоростью диффузии воды через узкие поры в продуктах реакции, окружающих негидратированные зерна цемента. На этой стадии вместо эттрингита образуется гидроалюминат кальция, часть оксида алюминия, в котором замещается оксидом железа; возможен также переход эттрингита в моносульфат.
Скорость гидратации портландцемента определяется скоростью гидратации отдельных минералов. Ю.М. Бутт расположил индивидульные минералы по убыванию степени их гидратации в следующие ряды: начальные сроки C3A>C4AF>C3S>C2S и поздние сроки C3S>C3A>C4AF>C2S.
Указанные отношения сохраняются и для минералов, находящихся в составе синтетических цементов, содержащих лишь CaO, SiO2, Al2O3 и Fe2O3. Если же в составе цемента присутствует сульфат кальция, то распределение соединений уже иное: C3S(алит)> C3A> C4AF >C2S(белит).
Используя современную технику - растровую электронную микроскопию ESEM - STARK недавно сделал дополнительные выводы по гидратации, что привело к уточненной модели (рисунок 1.39) [135, 136, 137, 138, 139]. Существенными отличиями от предыдущей презентации являются:
• временное образование метастабильной минеральной фазы сингенита (K2SO4·CaSO4·H2O) от агента сульфата и калия, который устанавливается в зависимости от степени сульфатации цемента в алюмината или присутствует в виде слегка растворимого K2SO4. В цементе богатом щелочами сингенит наблюдался в виде крупных агрегатов, в малощелочном цементе наблюдается в виде отдельных, пластинчатых или полосообразных кристаллов (см. рисунок 1.40). Первые кристаллы сингенита уже видны через несколько минут после добавления воды. Через 4-6 ч сингенит исчезает, возникает вторичный гипс, что приводит к увеличению образования эттрингита. Калий поступает в виде сульфата калия в поровом растворе;
• временное образование вторичного гипса из сингенита;
• C-S-H-фазы первой стадии (длиной до 300 нм) и конвертирование через несколько дней в гидратные фазы (длина 1,5 мк). Предыдущая идея, о том, что первоначально сформированные длинные волокна С-S-Н превращаются в короткие зернистые кристаллы, не может быть подтверждена с помощью электронных изображений Esem.
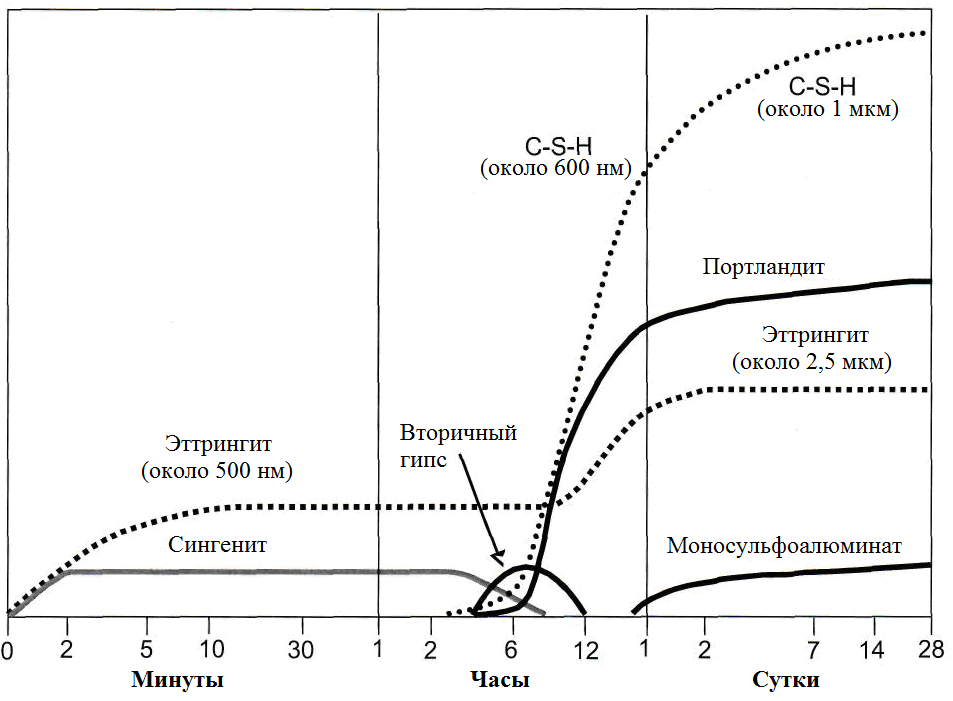
Рисунок 1.39- Схематическое представление процессов гидратации цемента в зависимости от времени по Старку [137]
Рисунок 1.40 - Кристаллы сингенита в цементе: пластинчатой формы синтетический сингенит (слева); агрегаты сингенита в щелочно-богатом гидратирующем цементе через 30 минут
Особый интерес представляют процессы на поверхности и внутри цементного зерна. На рисунке 1.41 представлена схема Шривенера [127], показывающая последовательность сроков формирования гидратных фаз на поверхности или внутри цементного зерна. В результате гидратации имеют место следующие процессы:
• в начале видны частицы различных минеральных фаз клинкера;
• через 10 минут часть С3А реагирует с водой с образованием на поверхности зерен аморфного алюминатного геля; После растворения CaSO4 появляются ростки "первичных" кристаллов эттрингита в поровом растворе и на поверхности зерна;
• примерно через 10 часов реакция C3S с водой привела к появлению наружного покрытия, состоящего из С-S-H;
• примерно через 18 часов образовался игольчатый эттрингит из-за процесса рекристаллизации и от новообразований; начинается гидратация C3S, которая контролируется процессом диффузии из внутренних зон зерна;
• через 1-3 дня эттрингит реагирует с С3А с образованием моносульфата (моносульфатной формы гидросульфоалюмината кальция ГСАК – 1);
• примерно через 2 недели процесс гидратации силикатных фаз значительно продвинулся вглубь зерна. Поскольку скорость образования C-S-H-фаз зависит от скорости диффузии, то процесс гидратации зерна цемента будет завершен только после нескольких месяцев, а более крупных частиц цемента - после нескольких лет.
Процесс гидратации происходит первоначально только в очень тонком пограничном слое клинкерного зерна. Образование малопроницаемых слоев продуктов гидратации на поверхности зерна с одной стороны, предотвращает попадание воды в негидратированные районы клинкера, во-вторых, этот слой затрудняет диффузию ионов из недр гидратирующего зерна цемента. Только после разрушения этого защитного слоя, гидратация снова происходит быстро и достигает более глубоких слоев в клинкере. Дальнейший ход гидратации контролируется диффузией. В зависимости от размера частиц, гидратация может длиться в течение нескольких недель, месяцев или даже лет. В начале производства технологии процесса помола цемента были не настолько совершенны, поэтому цемент раньше был относительно грубым. Это должно было означать, что бетон изготавливается из грубого цемента, скорость роста прочности медленная, рост прочности бетона происходит длительное время. При достаточном количестве воды процесс гидратации цемента протекает до тех пор, пока все частицы клинкера полностью не прогидратируются. Например, прочность бетона защитных бункеров времен 1-ой и 2-й мировой войны до сегодняшнего дня продолжает увеличиваться. Таким образом, прочность бетона может увеличиваться на протяжении десятилетий.
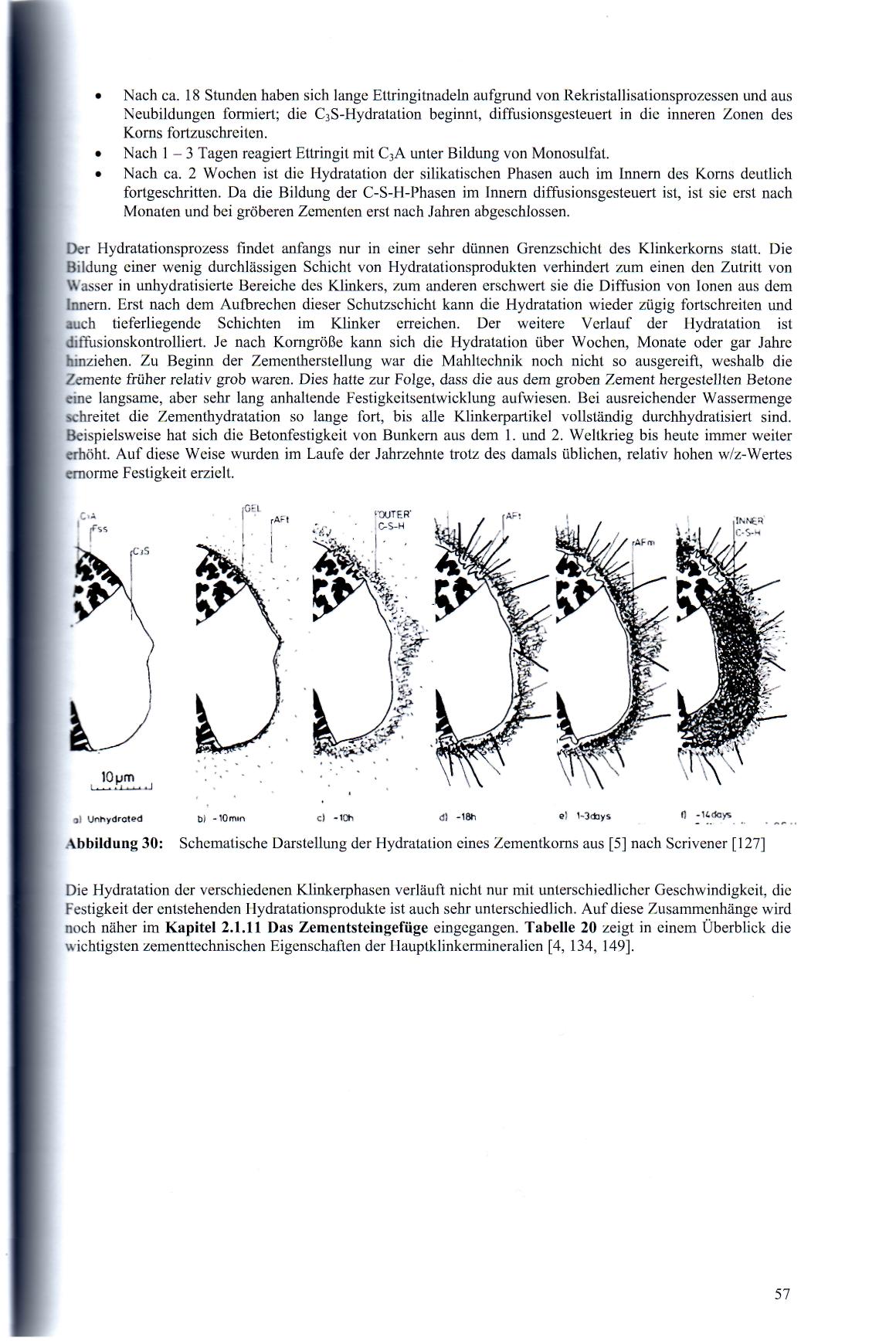
Рисунок 1.41- Схематическое представление гидратации цементного зерна от [5] до [127] по Шривенеру
Гидратация клинкерных фаз различных цементов происходит с различной скоростью, прочности полученных продуктов гидратации также очень разные. Эти вопросы обсуждаются более подробно в разделе 2.1.11. В таблице 1.22 представлен обзор важных вяжущих свойств основных клинкерных минералов [4, 134, 149].
Таблица 1.22-Основные технические характеристики цементного клинкера [33]
| Свойства | Алит | Белит | Алюминат | Феррит |
| Гидратационная способность | высокая | умеренная, в зависимости от скорости охлаждения и примесей | очень высокая, должна быть замедлена добавкой гипса | низкая |
| Прочность | высокая начальная прочность | высокая прочность при длительном твердении | способствует ранней прочности | очень низкая |
| Тепловыделение (при полной гидратации) | 500 Дж/г | 250 Дж/г | 1340 Дж/г | 420 Дж/г |
| Усадка гидратированных чистых фаз, % | 0,05 | 0,02 | 0,10 | 0,02 |
| Специальные характеристики | основной источник прочности в портланд-цементе | модификация имеет важное значение для развития прочности α >β>>γ | низкое сопротивление сульфатной агрессии | дает клинкеру и цементу цвет (по MgO серо-зеленый); |
| Стойкость | образуется много Ca(OH)2 →позитивно для карбонизации; → негативно для химической стойкости | при гидратации образуется меньше Ca(ОН)2→ плотная структура | реагирует с сульфатами → снижает сульфатостой-кость | устойчив к действию сульфатов |
