Особенности электронного строения диенов
С сопряженными связями
При наличии в молекуле двух двойных связей, расположенных через одну простую, наблюдается эффект сопряжения, который вызван взаимодействием p-электронных облаков: образуется единое p-электронное облако, охватывающее все 4 атома углерода. В результате этого:
1. выравнивается электронная плотность по всей системе связей: простые связи укорачиваютя, двойные – удлинняются;
2. возрастает способность к поляризации, т.к. под действием поляризующих агентов смещается все единое p-электронное облако;
3. поляризующее воздействие реагентов или заместителей передается по всей цепочке сопряженных связей без затухания с образованием чередующихся положительных и отрицательных зарядов. Например, в бутадиене под действием поляризующего реагента Н+ происходит следующая поляризация:
 +
+  -
-  +
+  -
-


 СH2=CH-CH=CH2 + H+
СH2=CH-CH=CH2 + H+
1,37 1,46
4. вследствие более равномерного распределения электронной плотности молекула бутадиена обладает высокой термодинамической стойкостью.
1,34 и 1,54 А0 у олефинов и парафинов
Физические свойства
1.Диеновые углеводороды обладают более высокой температурой кипения, чем олефины:
1,3-бутадиен - +4,5оС; 1-бутен – 6,3оС.
2.Плотность их также выше, чем у олефинов, т.к. растет % содержания С: у пентена – 0,64
у пентадиена – 0,70.
3.Также выше показатель преломления (1,4 – 1,47 вместо 1,36 – 1,38 у этиленовых) – экзальтация МR.
Химические свойства
Сопряженные диены дают все химические реакции, характерные для двойных связей. Отличительные особенности:
1. Более высокая термодинамическая стойкость.
2. Более высокая реакционная способность из-за очень большой поляризуемости.
3. Способность к присоединению по концам цепочки сопряженных связей.
1. Реакции присоединения
1. Присоединение водорода, галогенов, галогеноводородов может идти в положении 1,2 и в положении 1,4. Например, присоединение НCl, происходящее по электрофильному (ионному) механизму:
1 2 3 4 + +



 СH2=CH-CH=CH2 + H+
СH2=CH-CH=CH2 + H+ 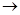 CH2=CH-CH-CH3
CH2=CH-CH-CH3  CH2-CH=CH-CH3
CH2-CH=CH-CH3 
CH2=CH-CH-CH3 CH2-CH=CH-CH3 CH2-CH=CH-CH3 CH3-CH-CH=CH2
Cl Cl Cl Cl
Продукт присоединения продукт присоединения
HCl в положение 1,2 HCl в положение 1,4
3-хлор-1-бутен 1-хлор-2-бутен
Наблюдается резонанс 1 и 2 структур карбкатиона.
Выход продукта возрастает при повышении температуры, полярности и поляризуемости реагента.
2. Реакция диенового синтеза (реакция Дильса-Адлера) – реакция присоединения, характерная только для сопряженных диенов. Эта реакция используется для качественного и количественного определения сопряженных диенов под действием непредельных соединений (диенофилов), у которых двойная связь активирована электроноакцепторными заместителями благодаря сопряжению с электроотрицательными атомами.
Например:
 -
-  +
+
СH3  +CH2
+CH2  - CH2
- CH2
 C CH
C CH
 - CH
- CH  + +
+ +  +C=O
+C=O  -
-
CH2 H
Изопрен акролеин

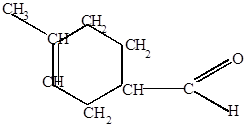
4-метил-3-циклогексенкарбальдегид
Роль диенофила могут выполнять и сами диеновые углеводороды (реакция Лебедева):
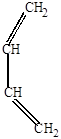 | CH2 +СH-CH=CH2 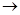 | 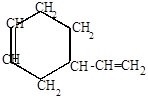 |
4-винил-1-циклогексен
2. Реакции окисления
Диены легко окисляются за счет активных двойных связей. Реакции идут так же, как у олефинов, за счет разрыва двойной связи.
1. Под действием озона:
СH2=CH-CH=CH2 + 2O3  CH2-CH-CH-CH2
CH2-CH-CH-CH2  CH2 + CH-CH + CH2
CH2 + CH-CH + CH2
O-O-O O-O-O -H2O2 O O O O
2. Окисление молекулярным кислородом протекает:
а) с образованием перекисных олигомеров
 CH2=CH-CH=CH2 + O2
CH2=CH-CH=CH2 + O2  (-CH-CH2-O-O-)n
(-CH-CH2-O-O-)n
CH
CH2
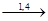 (-CH2-CH=CH-CH2-O-O-)n
(-CH2-CH=CH-CH2-O-O-)n
б) могут образовываться циклоперекисные продукты, здесь молекула кислорода работает как диенофил.
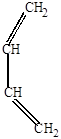 | + O  O O | 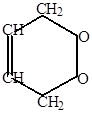 |
в) при высоких температурах и при наличии насыщенных звеньев может идти реакция окисления в a-звене.
H
CH2=CH-CH=CH-CH3 + O2  CH2=CH-CH=CH-CH
CH2=CH-CH=CH-CH 
H O-O-H
 H2O + CH2=CH-CH=CH-C
H2O + CH2=CH-CH=CH-C
O
Винилакролеин
3. Реакции полимеризации
Полимеризация диеновых углеводородов происходит в основном за счет 1,4-присоединения, хотя известны и 1,2-полимеры. Механизм реакций может быть ионным (металлические, металлорганические катализаторы) или свободно-радикальлным (в присутствии перекисного индикатора)

 (-CH2-CH=CH-CH2-)n 1 тип
(-CH2-CH=CH-CH2-)n 1 тип
СH2=CH-CH=CH2  (-CH2-CH- )n 2 тип
(-CH2-CH- )n 2 тип
CH=CH2
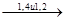 (-(CH2-CH=CH-CH2)x-(CH2-CH))n
(-(CH2-CH=CH-CH2)x-(CH2-CH))n
CH
CH2 3 тип
III тип полимеризации наблюдается при использовании щелочных металлов в качестве катализатора. I и II тип полимеризации наблюдается при использовании катализатора Циглера.

 Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
H H H CH2-
C=C C=C
-CH2 CH2- -CH2 H n
цис- транс-
1,2-стереорегулярные полимеры могут быть изотактическими или синдиотактическими.
CH2
CH
(-СH2-CH-)n (-CH2-CH-CH2-CH-)n
CH CH
CH2 CH2
изотактический синдиотактический
Нестереорегулярные полимеры – атактические с беспорядочным расположением ответвлений.
Полимеры диеновых углеводородов представляют собой очень эластичные каучукообразные вещества и применяются как заменители или синтетические аналоги натурального каучука в производстве резиновых изделий.
