Типы кристаллических решеток. Межмолекулярное взаимодействие.
К решению этих тестов надо обязательно вернуться после подробного изучения свойств металлов и неметаллов и их соединений в разделе неорганической химии.
Материалы к занятию №4
Степень окисления и валентность.
Типы кристаллических решеток. Зависимость свойств веществ от особенностей их кристаллической решетки
Основные понятия и законы химии. Закон Авогадро.Молярный объем относительные плотности газов.
Домашнее задание
1.Теория:
А.С.Егоров Химия. Репетитор, 2013:
1) §3.8 §3.9, §3.10,
2)§1.8 и задания для самостоятельной работы №№ 1-7,с.41
2.Упражнения:
В.Н. Доронькин и др. Тренировочная тетрадь"Общая химия;" Ростов-на-Дону, Легион ,2013
1) с.62- №№ 3.4;3.5, с.63 ,№№ 3.11, 3,14, с.64 №3.15
2) с. 8-9 (примеры), с.11 №№ 1.1.6-1.1.7.задачи.
Тесты
1.В.Н. Доронькин и др. Химия Тематические тесты. Базовый и повышенный уровень,Ростов-на- Дону, Легион , 2014 Вопрос А5 (5) и А6(6)
2.ЕГЭ. Химия Типовые экзаменационные варианты, под редакцией А.А. Кавериной 2015, вопросы 4 и 5 (варианты с 1 по 30)
Электронные тесты
4.Любые другие тесты-вопрос –А4(4), А-5(5) (Вопросы, по рассматриваемой теме)
Тесты
Степень окисления и валентность
Тест 1
. 1. Одинаковую степень окисления фосфор имеет в соединениях:
1) Ca3P2 и H3PO4 2) KH2PO4 и KPO3 3) P4O6 и P4O10 4) H3PO4 и H3PO3
2.Степень окисления атомов углерода последовательно возрастает в ряду соединений (ионов) , формулы которых:
1. СО2, СС14, NaHCO3
2. СO, СС14, СаС2
3. СаС2„ СО, НСО3-
4. CF4,CO32- , А14С3.
3. Степень окисления, равную +6, атом хрома имеет в соединении:
1) CrCl3 2) K2Cr2O7 3) Cr2S3 4) KCrO2
4. Максимальную и минимальную степени окисления атом брома проявляет в составе:
1) НВrO2, и КВг
2) ВrO4 и BrF
3) BrF7 и GaBr3
4) BrCl и BrO3-.
5. Наибольшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
6.Что изменяется в результате протекания реакции, схема которой:
Mg2Si + Н20 → Mg (ОН) 2 + SiH4↑
1. степень окисления атомов Si
2. степень окисления атомов Н
3. химическое количество веществ
4. степень окисления атомов Mg.
7. Укажите соответственно валентность и степень окисления атома азота в молекуле анилина
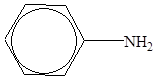
1) IV и -3
2) IV и -2
3) III и -3
4) III и -2.
8. Степень окисления хлора в Ca(ClO2)2 равна:
1) 0 2) -3 3) +3 4) +5
9.Степень окисления атомов серы последовательно возрастает в ряду:
1. PbS, SC12, SF4, SO3
2. Na2SO4 , SO32- , H2S2, HS-
3. HSO3-, HSO4-, SCl2, Ca2S
4. FeS2, H2S2, H2S, HS2.
10.Степень окисления серы в соединении FeSO3 равна:
1) -1 2) +2 3) 0 4) +4
Тест 2
1. Молекулы H2O и H2O2 между собой различаются:
1. валентностью атомов О
2. степенью окисления атомов О.
3. массой
4. массовой долей атомов О.
2.Наименьшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
3.Степень окисления атома кислорода положительная в составе:
1) С12O5,
2) OF2
3) O2F2
4) H2O2
4.Степень окисления и валентность кислорода в соединении ВаО2 соответственно:
1) -2 и II 2) +2 и II 3) -1 и I 4) +1 и I
5.Максимальная степень окисления равна номеру группы для атомов:
1) Си и С1
2) N и S
3) Si и О
4) О и F.
6.Максимальная степень окисления кислорода в соединении:
1) Al2O3 2) Na2O2 3) F2O 4) O3
7.Валентность азота равна его степени окисления в молекуле …
1. аммиака
2. азотной кислоты
3. азота
4. оксида азота (II)
8.Чему равно валентность и степень окисления железа в комплексном ионе [Fe(CN)6]3-?
1. VI; +3
2. III; +3
3. VI; -3
9.Какой из перечисленных элементов может иметь в соединениях как положительную, так и отрицательную степень окисления?
1. Аргон
2. Фтор
3. Бром
4. ЖелезоI; +6
10.У какого элемента максимальная степень окисления равеа номеру группы
1) неон
2) сера
3) фтор
4) кислород
Типы кристаллических решеток. Межмолекулярное взаимодействие.
Тест 1
1.Кварц, кремень, горный хрусталь, аметист, яшма образованы одним и тем же веществом с атомной кристаллической решеткой. Формула этого вещества:
1) SiO (II)
2) SiO2 (IV)
3) K2SiO3
4) CaSiO3
2. К веществам молекулярного строения не относится:
1) хлор
2) оксид серы
3) иод
4) бромид калия
3. Атомную кристаллическую решетку имеет
1) хлороводород
2) вода
3) поваренная соль
4) кремнезем
4.К веществам с атомной кристаллической решеткой относятся
1) натрий, фтор, оксид серы (IV)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4)хлорид калия ,белый фосфор, иод
5. Атом является структурной частицей в кристаллической решётке
1) метана
2) водорода
3) кислорода
4) кремния
6 Кристаллическую структуру, подобную структуре алмаза, имеет
1) кремнезем SiO2
2) оксид натрия Na2О
3) оксид углерода (II) СО
4) белый фосфор Р4
7. Какие из приведенных утверждений верны:
А Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность.
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
8. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решётку
1)ионную
2)металлическую
3)молекулярную
4)атомную
9. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие
2) хрупкие и легкоплавкие
3) проводят электрический ток в растворах
4) проводят электрический ток в расплавах
10. Наличие запаха следует ожидать у вещества:
1) поваренная соль
2) хлорид меди (II)
3) иод
4) сероводород
Тест 2
1. Кристаллическая решетка оксида углерода(IV)
1. ионная 3) металлическая
2)молекулярная 4) атомная
2. Веществом молекулярного строения является
1. озон 3) графит
2. оксид бария 4) сульфид калия
3. Наибольшую температуру плавления имеет:
1) сахар
2) поваренная соль
3) вода
4) иод
4. Ионы являются структурными частицами
1) кислорода
2) воды
3) оксида углерода (IV)
4) хлорида натрия
5. Кристаллическая решетка хлорида кальция
1) ионная 3) металлическая
2) молекулярная 4) атомная
6. Кристаллическая решетка графита
1. ионная 3) атомная
2)молекулярная 4) металлическая
7. Молекулярное строение имеет каждое из соединений
1) C2H5OH,H2S 3) Ca(OH)2, NH3
2) CaBr2,NO2 4) KNO3,Na2S
8. Молекулярную кристаллическую решетку имеет
1)H2S 2)NaCl 3)SiO2 4)Cu
9.Атомную кристаллическую решетку имеет
1)хлорид натрия и алмаз 3)оксид углерода (IV) и кремний
2)алмаз и графит 4)оксид кремния (IV) и красный фосфор
10.Термин « молекула» неприменим к веществам
1) SiO2 3) C6H12O2
2) NaCl 4) C(графит)
Тест 3
1. Температура плавления веществ последовательно возрастает в рядах:
1)хлор, иод, карбонат кальция
2)вольфрам, литий, глюкоза
3)водород, бром, графит
4)гелий, сероводород, поваренная соль
2. Наличие запаха следует ожидать у вещества:
1) серебро
2) кремниевая кислота
3) нафталин
4) графит
3. Температура плавления твердых веществ последовательно возрастает в ряду:
1) HCl, HBr, HI
2) HBr, HI, HCl
3) HI, HBr, HCl
4) HI, HCl, HBr
4. Металлы имеют кристаллическую решетку
1) ионную
2) металлическую
3) молекулярную
4) атомную
5. Кристаллическая сера имеет кристаллическую решетку
1) ионную
2) атомно-ионную
3) молекулярную
4) атомную
6. Термин « молекула» применим к веществам
1) Na2O2 3) Al4C3
2) NaCl 4) H2O
7. Наиболее высокую температуру плавления имеют вещества
1)NaCl 2)H2O 3)C2H5OH 4)Cu
8. Вещества молекулярного строения характеризуются
1) низкой температурой плавления и кипения
2) непостоянством состава
3) невысокой твердостью
4) электропроводностью
9. Укажите тип кристаллической решетки вещества, образованного атомами элементов с сокращенными электронными конфигурациями ... 3s2 и ... 3s23p5:
1) атомная
2) ионная
3) молекулярная
4) металлическая
10. Простые вещества VIIА группы в твердом состоянии имеют кристаллическую решетку
1)ионную
2)металлическую
3)молекулярную
4)атомную
Материалы к занятию №5
Классификация неорганических соединений. Простые и сложные вещества.
Оксиды-основные, амфотерные и кислотные.
Основания. Кислоты.
Задачи с участием газов: расчеты по химическим уравнениям.
Домашнее задание:
1.Теория:
А.С.Егоров Химия. Репетитор, 2013:
1) §2.1- §2.4 §6.1-6.3. Обязательно- упражнения после параграфов.
2.Упражнения:
В.Н. Доронькин и др. Тренировочная тетрадь"Общая химия;" Ростов-на-Дону, Легион ,2013
1) с.82- №№ 6.1-6.24
2) с. 11 (пример 9), задачи с.15 №№ 1.2.1, 1.2.11-1.2.14, 1,2.16-1.2.18, 1.2.23, 1.2.26
Стр.118.№№ 11.2.1-11.2.15 Вопрос А28 или по новой классификации -26
Тесты
1.В.Н. Доронькин и др. Химия Тематические тесты. Базовый и повышенный уровень,Ростов-на- Дону, Легион , 2014:
Вопрос А7(7) только неорганические соединения ,и А9(9),А10(10).
Вопрос В5Сделать задания, связанные со свойствами оксидов, оснований и кислот.
2.ЕГЭ. Химия Типовые экзаменационные варианты, под редакцией А.А. Кавериной 2015,:
Вопросы 6,8, и 9(варианты с 1 по 30) и 31 Сделать задания, связанные со свойствами оксидов, оснований и кислот.
Электронные тесты
4.Любые другие тесты-вопрос –А7(7), А-9(9)и А(10) (Вопросы, по рассматриваемой теме)
Тесты.
Оксиды
Для успешного ответа по тестам ОКСИДЫ, надо не только знать, но и уметь:
1) отнести оксид к соответствующему типу (кислотный, основной, амфотерный, несолеобразующий), назвать его по международной и тривиальной (если таковая существует)номенклатурам и написать структурную формулу
2) оценить изменение кислотных , основных свойств оксидов или характер связей в данном ряду соединений
3) написать уравнение любой реакции, характеризующей кислотные ,или основные или амфотерные свойства данного оксида.
4) написать уравнения особых реакций,свойственных для данного оксида-это обычно ОВР; м.б. реакции термического разложения или др
5) писать уравнения реакций получения любого типа оксидов
Тест 1
1. Среди следующих веществ оксидом не является:
1) ВаO2 2) МnO2 3) РbO2 4) NO2
2. Основный оксид не может быть получен при термическом разложении:
1) Си(ОН)2, 2) КОН 3) Fe(OH)2 4) СаСО3
3. Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
4. Оксид углерода(IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и оксидом серы(IV)
3) сульфатом калия и гидроксидом натрия
4) фосфорной кислотой и водородом
5. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) КОН + SО3(изб)→ 1) КНSО4
Б) КОН(изб) + SО3 → 2) К2SО3
В) КОН + СО2 (нзб) → 3) К2СО3 и Н2О
Г) КОН(изб) + СО2 → 4) К2SО4 и Н2О
5) КНСО3
6. Только кислотные оксиды расположены в ряду:
1) СО2, Мn2О7, SО3 3) СгО, SО2, СаО
2) Nа2О,SiO2, Сг2О3 4) СuО, А12О3, FeО
7. Между собой взаимодействуют
1) SiO2и Н2О
2) СО2 и Н2SО4
3) СО2 иСа(ОН) 2
4) Nа2O и Са(ОН) 2
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) CO2+H2O → 1) CaCO3
Б) CO2+CaO → 2) CaCO3+H2O
В) CO2(избыток) + Са(ОН) 2(2:1)
Г) CO2+ Са(ОН) 2(1:1)
3) Ca(HCO3) 2
4) CO+H2
5) H2CO3
6)Са (НСО3)2 + Н2О
| Г4 | |||
9. Оксид серы (VI) реагирует с каждым из двух веществ:
1) водой и гидроксидом кал.ия
2) кислородом и оксидом серы(IV)
3) нитратом натрия и гидроксидом натрия
4) фосфорной кислотой и водородом
10.Вещество, которое может реагировать с водородом, серной кислотой и алюминием,
имеет формулу
1) Р2О5 2) СиО 3) Ва(NО3)2 4) К2О
Тест 2
1. Оксид серы(IV) не взаимодействует с
1) О2
2) Н2О
3) СО2
4) NаОН
2. Кислотным и основным оксидом являются соответственно
1) SО2и MgО 3) Na2O и FеО
2) СО2 и А12О3 4) ZnО и SО3
3. Оксид хрома (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) оксид кальция и гидроксид натрия
4) вода и медь
4. Кислотным и основным оксидом являются соответственно
1) SО2 и FеО
2) СО2 и А12О3
3) МnО и Nа2О
4) ZnО и SО3
5.Оксид серы(IV) проявляет свойства
1) основного оксида
2) амфотерного оксида
3) кислотного оксида
4) несолеобразующего оксида
6. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)Al2O3+NaOH  1)NaAlO2
1)NaAlO2
Б)Al2O3+NaOH+H2O→ 2) NaAlO2+H2O
В)Al2O3+Na2CO3  3) NaAlO2+CO2
3) NaAlO2+CO2
Г)Al2O3+HCl→ 4) Na[Al(OH)4]
5) AlCl3+H2O
6) AlCl3+H2
| А | Б | В | Г |
7. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)P2O3+H2O→ 1)H3PO2
Б)P2O5+H2O→ 2) H3PO3
В)P2O5+MgO→ 3) H3PO4
Г)P2O5+Mg(OH)2→ 4) Mg3(PO4)2
5) Mg3(PO4)2+H2
6) Mg3(PO4)2+H2O
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) SO2+H2Oà 1) CaSO3+H2
Б) SO3+H2Oà 2) CaSO3+H2O
В) SO2+Ca(OH)2à 3) CaSO4+H2
Г) SO3+Ca(OH)2 à 4) CaSO4+H2O
5) H2SO3
6) H2SO4
9.Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА ВЕЩЕСТВА
А)оксид кремния (IV) 1) Al,HNO3,CO
Б)оксид азота(IV) 2) FeO,CO2,H2O
В)оксид бария 3) C, KOH,CaCO3
Г)оксид железа(III) 4)NaOH,H2O, CaO
5) H2O,SO3, H3PO4
6) H2O, HNO3, Ca(OH)2
| А | Б | В | Г |
10. К амфотерным оксидам относится
1) CrO3 2) SО3 3) СО2 4) Сг2О3
Тест 3
1. Число соединений из указанных (H2O, H2SO4, P2O5, Na2O, КОН, SiO2), с которыми взаимодействует оксид азота (V), равно:
1) 6 2) 5 3) 4 4) 3
2. Соль образуется, когда с соляной кислотой реагируют:
1) CO2
2) CaO
3) SO2
4) Al2O3
3. Укажите формулы веществ, при взаимодействии
которых с Mn2O7 образуется соль:
1) K2O 2) HNO3 3) NaOH 4) H2O
4. Соль образуется, когда оксид хрома (VI) реагирует с:
1) H2O 2) NaOH 3) H2SO4 4) CaO
5. Основные свойства могут проявлять оксиды:
I) SO2 2) Al2O3 3) CaO 4) P2O5
6. С водой при 200C обратимо взаимодействуют оксиды:
1) P2O5 2) CO2 3) SO2 4) SO3
7. Соль образуется, когда оксид кальция реагирует с:
1) водой 2) оксидом серы (VI) 3) оксидом калия 4) фосфорной кислотой
8. Кислота образуется, когда с водой по отдельности
реагируют все оксиды ряда (20°С):
1) SO3 , P2O5 , Mn2O7 , CrO3
2) N2O5 , SO2 , SO3 , ZnO
3) CO2 P2O5, N2O, SiO2
4) SO3 , CrO3, K2O, Al2O3
9. Основный характер оксида меди (II) показывают схемы реакций:
l) CuO→ Cu2O+ O2
2) CuO + HCl → CuCl2 + H2O
3) CuO + SO3 → CuSO4
4) CuO + H2 → Cu + H2O
10. Кислотный характер оксида кремния (IV) показывают схемы реакций:
I) SiO2 + С → Si + СО
2) SiO2+ K2O → K2SiO3
3) SiO2 + NaOH → Na2SiO3 + H2O
4) SiO2+ Mg →Si + MgO
Основания
Для успешного ответа по тестам основания (гидроксиды), надо не только знать, но и уметь:
1) отнести основание к соответствующему типу –типичное основание или амфотерное , назвать его по международной и тривиальной (если таковая существует)номенклатурам и написать структурную формулу
2) написать уравнение любой реакции, характеризующей химические свойства оснований и амфотерных гидроксидов.
3) написать уравнения реакций получения растворимых и нерастворимых оснований
знать4) разницу в химических реакциях растворимых и нерастворимых оснований
Тест1
.1 Основания – это сложные вещества, при диссоциации которых образуются
1) ионы водорода и кислотных остатков
2) ионы металлов и кислотных остатков
3) ионы металлов или аммония и гидроксид –ионы
4) катионы аммония и анионы кислот
2.Для получения щелочей в технике обычно используют
1) гидролиз солей щелочных металлов
2) термическое разложение солей щелочных металлов
3) электролиз водных растворов хлоридов щелочных металлов
4) взаимодействие щелочных и щелочно-земельных металлов или их оксидов с водой
3.Основания делят на 2 группы
1) растворимые и нерастворимые
2) одноосновные и двухосновные
3) взаимодействующие с кислотами и не взаимодействующие с ними
4) гидроксиды металлов и гидроксиды неметаллов
4. Растворимые основания – это сильные электролиты.Единственное исключение-это
1) LiOH
2) NH4OH
3) CsOH
4) NaOH
5. В ряду Be(OH)2 - Mg(OH)2 - Ca(OH)2 - Sr(OH)2 - Ba(OH)2 растворимость в воде и их сила
1) уменьшается 2) увеличивается 3) не изменяется 4) все эти основания - нерастворимы
6. Число гидроксидов среди перечисленных веществ HNO3, NaOH, CuSO4, CO2, KCl, H3PO4, Ba(OH)2 , Zn(OH)2, H2SO4
1) 3 2) 4 3) 5 4) 6
7. Свойства гидроксидов s-металлов II группы с увеличением заряда ядра атомов изменяются в следующей последовательности
1) щелочь – нерастворимое основание – амфотерный гидроксид
2) амфотерный гидроксид– нерастворимое основание– щелочь
3) кислота – амфотерный гидроксид– щелочь
4) основание –амфотерный гидроксид– кислота
8. Раствор гидроксида калия реагирует с каждым из веществ группы
1) оксид кремния, фосфат натрия, бром, гидроксид цинка
2) оксид меди(II), железо, азотная кислота, гидроксид цинка.
3) оксид кремния, гидроксид цинка, алюминий, азотная кислота
4) оксид меди(II), железо,аммиак, гидроксид цинка
9. При нагревании гидроксида меди (II) образуются
1) Cu и H2O 2) CuO и H2 3) CuO и H2O 4) Cu2O и H2O
10.Амфотерные свойства проявляют
1) Ba(OH)2
2) Zn(OH)2,
3) Be(OH)2
4) Mg(OH)2
5) Cr(OH)3
6) Sn(OH)2 . Ответ:____ Ответ запишите цифрами без пробелов
Тест2
1.Гидроксид меди (II) можно получить при взаимодействии:
I) Cu и Н2O
2) CuO и Н2O
3) CuCl2 и KOH (р-р)
4) Cu и KOH (р-р)
2.Гидроксид кальция не взаимодействует с
1) HCl 2) CO2 3) CuS 4) HNO3
3. Гидроксид натрия взаимодействует с
1) SO3 2) Na2O 3) Mg(OH)2 4) N2O
4. Раствор гидроксида лития реагирует с каждым из веществ, указанных попарно
1) хлоридом железа (III) и углекислым газом
2) оксидом железа (II) и азотной кислотой
3) серной кислотой и карбонатом кальция
4) оксидом алюминия и хлоридом калия
5. Гидроксид железа (III) взаимодействует с каждым из двух веществ
1) KOH и H2SO4
2) Cu(OH)2 и HCI
3) HNO3 и Na2SO4
4) HCl и BaCl2
6. Гидроксид хрома (III) взаимодействует с каждым из двух веществ:
1) СО2 и HCl
2) SiО2 и Cu(OH)2
3) NО и NaNO3
4) H2SO4 и NaOH
7. Амфотерными являются все гидроксиды в ряду
1) Ba(OH)2 , Zn(OH)2, Cr(OH)3
2) Аl(OH)3 , Cr(OH)3, Fe(OH)3
3) NH4OH, Pb(OH)2 , Аl(OH)3
4) Cr(OH)3 ,Sn(OH)2, Ca(OH)2
8. Гидроксид алюминия взаимодействует с каждым из двух веществ
1) HCl и Zn
2) HCl и NaOH
3) CO иH2S
4) BaCI2 и Ca(OH)2
9. Реакция нейтрализации происходит между
1) алюминием и серной кислотой(разбавленной)
2) серной кислотой и нитратом бария
3) серной кислотой и гидроксидом меди (II)
4) гидроксидом бария и хлоридом меди (II)
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А)Al(OH)3+RbOH(водный раствор) 1)NaAlO2
Б) Al(OH)3+NaOH → 2) NaAlO2+H2O
В) Al(OH)3+Na2CO3  3) NaAlO2+CO2
3) NaAlO2+CO2
Г) Al(OH)3+HCl→ 4) Na[Al(OH)4]
5) AlCl3+H2O
6) Rb[Al(OH)4]
Ответ запишите цифрами без пробелов
Тест 3
1. Щелочь образуется при взаимодействии:
1) FeCl2 и NaOH (р-р)
2) NaNO3 и Ca(OH) 2 (р-р)
3) BaH2 и H2O
4) CaO и Н2O
2.Гидроксид железа (II) можно получить при взаимодействии:
I) Fe и Н2O
2) FeO и Н2O
3) FeCl2 и NaOH (р-р)
4) Fe и KOH (р-р )
3.Укажите формулы веществ, с которыми в водном растворе реагирует Cu(OH)2:
1) HNO3
2) HCl
3) NaOH (разб.)
4) K2SO4
4. Сколько веществ из указанных CaO, BeO, N2O5, CuSO4, Na2SiO3 реагируют
с KOH (р-р)?
1) 5
2) 4
3) 3
4) 2
5. Химическое взаимодействие возможно между:
1) KOH и SiO2
2) Al2O3 и NaOH
3) Fe(OH)2 и K2SO4 (р-р)
4) Ca(OH)2 (р-р) и P2O5
6. Гидроксид цинка в водном растворе реагирует с:
1) CuSO4
2) CaCl2
3) Ba(ОН)2
4) H2SO4
7. С гидроксидом натрия в водном растворе реагирует каждое из веществ в рядах:
1) ) N2O5 , H2SO4 , Cr2O3
2) Al2O3 , SO2, FeSO4
3) Al2O3 , Na2CO3, SО3
4 )Al , Al(OH)3 , CuCl2
8. Гидроксид алюминия может образоваться при взаимодействии:
1) А12O3 и Н2O
2) Al2(SO4)3 и NH4 OН (избыток)(NH3 ∙Н2O)
3) AlCl3 и NaOH (избыток)
4) А12O3 и KOH (р-р)
9. Кислотные свойства Be(OH)2 проявляет, реагируя с:
1) HCl
2) H2SO4
3) NaOH
4) Ba(OH) 2
10. Основные свойства Cr(OH)3 проявляет, реагируя с водными растворами:
1) HNO3
2) КОН
3) HCl
4) NaOH
Кислоты
Тест 1
1. Формулы только слабых кислот приведены в ряду:
1) H2SO4 , HClO4 , HNO3
2) CH3COOH , H2CO3 , H2S
3) HCl , HBr, HF
4) HI , HF, H2S
2. Формулы только сильных кислот приведены в ряду:
1) HF, HCl , HNO3
2) HCl , HNO3 , H2SO4
3) H3PO4 , HClO4 , HCl
4) H2SO3 , H2SO4 , CH3COOH
3. Формулы только ортокислот приведены в ряду:
1) H3SbO4 HSbO3, , H3SbO3
2) HCl , HNO3 , H2SO4
3) H3PO4 , H3AsO4 , H3PO3
4) H2SO3 , H3BO3 , CH3COOH
4. Формулы только дикислот (пиро)приведены в ряду:
1) H4P2O7, H2Сr2O7, , H2S2O7,
2) HCl , HNO3 , H2SO4
3) H3PO4 , H3AlO3 , H2CrO4
4) H4SiO4 , H2SiO3 , H3SbO4
5. Формулы кислот, которые могут образовывать кислые соли:
1) H2S
2) CH3COOH
3) H3PO4
4) H2SO3
6. Нитрат образуется, когда разбавленная азотная кислота реагирует с:
1) CO2
2) Cu(OH)2
3) NaCl
4) Al2O3
7. Заряд каких кислотных остатков равен 1-:
1) гидросульфид-ион
2) гидрофосфат-ион
3) гидросульфит-ион
4) гидросульфат-ион
8. Непосредственным взаимодействием воды и кислотного оксида можно получить кислоты:
1) серную
2) фосфорную
3) кремниевую
4) соляную
9.Кислота образуется при взаимодействии
1) SiO2 и Н2O
2) АgNO3 (разб.) и Н3РО04(разб.)
3) BaCl2 и HNO3 (разб.)
4) NO и H2O
10.Газ выделяется, когда между собой реагируют
I) KCl (т) и Н2SO4 (конц.)
2) K2CO3 и CH3COOH
3) CaSO3 и HCl (конц.)
4) KCl (т) и HNO3 (разб.)
Тест 2
1..При растворении в холодной воде оксида азота (Ш) образуется:
1) HNO3
2) HNO2
3) смесь HNO3 и HNO2
4) смесь HNO2 и NО
2. Кислотные свойства наиболее ярко выражены у вещества ,формула которого
1) NН3
2) H2S
3) Н2SO4
4) HF
3. Формула самой слабой кислоты
1) HBr
2) HBrO4
3) Н2SO4
4) НOCl
4. В ряду кислот НClО- НClО2- НClО3- НClО4- окислительная активность
1) увеличивается
2) не изменяется
3) уменьшается
4) увеличивается незначительно
5. Самой сильной кислотой является:
1) HNO2
2) HNO3
3) НCl
4) НClО4
6. В каком из вариантов формулы кислот перечислены в последовательности:
хлорная- пирофосфорная – метафосфорная - стеариновая
1) НClО- Н2S2O3 - H3PO4 - C17H35COOH
2) НClО4- H4P2O7- HPO3 - C17H35COOH
3) НClО2- H3PO4- H4P2O7-C17H35COOH
4) НClО- H4P2O7- HPO3-CH3COOH
7. Какую окраску приобретает индикатор в кислой и щелочной среде соответственно:
1) красный,желтый
2) синий,красный
3)фиолетовый , бесцветный
4) желтый, красный
8. Какова окраска лакмуса в растворе, полученном при смешивании 4,0 г азотной кислоты 4,0 г гидроксида натрия
1) красный,
2) синий,
3) фиолетовый
4) желтый
9. Соляная кислота реагирует с каждым из двух веществ
1) Zn и Ca(OH)2
2) Ag и Au
3) KOH и CO2
4) NaOH и Ag
10. Верны ли следующие суждения о свой ствах угольной кислоты
А.Угольная кислота- сильный электролит
Б Угольная кислота образует кислые и средние соли
1) верно только А
2) верно только Б
3) верны оба суждения
4)неверны оба суждения
Тест 3
1. Соляная кислота взаимодействует при обычных условиях со всеми веществами набора:
1) KHCО3, Ва, Fe(OH)3
2) Li2О, Сu, Pb(NО3)2 (р-р)
3) ZnO, KNO3 (р-р), Fe
4) СО2, AgNO3 (р-р), Mg
2. Вещества, с которыми может взаимодействовать как соляная кислота, так и водный раствор гидроксида калия, — это:
1) Zn, СO2, Ве(ОН)2
2) КНСO3, CH3COONH4, А12O3
3) Zn(OH)2, Al, CuBr,
4) Са(НСОэ)2, Си, Сг2O3
3. Хлорноватая кислота является гидратом:
1) оксида хлора (I)
2) оксида хлора (III
3) оксида хлора (V)
4) оксида хлора (VII)
4. Дихромовая кислота, гидроксид свинца (II) и азотистая кислота являются гидратами соответственно следующих оксидов:
1) Сr2O3, РbО, NO2
2) СrO3, РbО, N2O5
3) СrO3, РbO2, N2O3
4) СrO3, РbО, N2O3
5. Соляная кислота взаимодействует при обычных условиях со всеми веществами набора:
а) CaCО3, Mg, Al(OH)3
в) K2О, Ag, Pb(NО3)2
б) SnO, LiNO3, Al
г) SО2, AgNO3, Mn
6. И разбавленная серная кислота, и разбавленный водный раствор гидроксида калия взаимодействуют с каждым из веществ набора:
1) гидроксид меди (II), гидроксид цинка, оксид алюминия
2) хлорид бария, цинк, гидроксид алюминия
3) хлорид аммония, гидроксид хрома (III), оксид углерода (IV)
4) алюминий, оксид цинка, гидрокарбонат калия
7. Все три вещества — хлорид алюминия, уксусная кислота и гидроксид калия — реагируют с:
1) AgNO3 2) НВr 3)СаСO3 4) (NH4)2CO3
8.Формулы кислоты, нормальной соли и амфотерногогидроксида соответственно:
1) NH3, CaSO4, А1(ОН)3
2) HBr, A12(SO4)3, Zn(OH)2
3) HNO3, NH4C1, Ва(ОН)2
4) H2SO4, KHCO3, Cr(OH)3
9.Формулы щелочи, основной соли и двухосновной кислоты соответственно:
1) Ва(ОН)2, А1(ОН)2С1, H2S
2) NaHCO3, A12(SO4)3, H3PO4
3) КОН, NaCl, Н2СO3
4) KOH, KHCO3, H2SO3
10. Гидроксид цинка, гипохлорит натрия, гидрокарбонат кальция — это соответственно:
1) основание, кислая соль, основная соль
2) амфотерный гидроксид, нормальная соль, кислая соль
3) амфотерный гидроксид, основная соль, кислая соль
4) основание, нормальная соль, основная соль
Материалы к занятию № 6
Амфотерные гидроксиды.Соли: средние,кислые,основные.
Взаимосвязь неорганических соединений («цепочки»).
Задачи с участием газов. "Избыток-недостаток".
Домашнее задание:
1.Теория:
А.С.Егоров Химия. Репетитор, 2013:
1) §2.4-2.5 §6.3-6.4. Обязательно упражнения после параграфов
2.Упражнения:
В.Н. Доронькин и др. Тренировочная тетрадь"Общая химия;" Ростов-на-Дону, Легион ,2013
1)с.76-81, №№ 5.1-5.14
2) с.87- №№ 6.18-6.20, 6.25-6.36
3) с. 23 (пример 18, 20), задачи с.30 №№ 1.3.23 1.3.24,, 1.3.26, 1.3.27, 1.3.31, 1,3,43-1.3.46, 1.2.23,
Тесты
1.В.Н. Доронькин и др. Химия Тематические тесты. Базовый и повышенный уровень,Ростов-на- Дону, Легион , 2014
Вопрос А7(7) только неорганические соединения , А10(10), А11(11), А12(12).
Вопрос В5Сделать задания, связанные со свойствами амфотерных гидроксидов и солей.
2.ЕГЭ. Химия Типовые экзаменационные варианты, под редакцией А.А. Кавериной 2015:вопросы 6,10, 11 и 31,32 только неорганические соединения (варианты с 1 по 30)
Электронные тесты
4.Любые другие тесты-вопрос –А-9 (9), А10 (10), А11(11) 31,32(Вопросы, по рассматриваемой теме)
Для успешного ответа по тестам СОЛИ надо не только знать, но и уметь:
1) отнести соль к соответствующему типу (средняя, кислая, основная, комплексная, двойная и смешанная), назвать ее по международной и тривиальной (если таковая существует)номенклатурам и написать структурную формулу
2) предложить всевозможные способы получения средней, кислой, основной соли и написать уравнения соответствующих реакций
3) написать уравнения реакций, характеризующих химические свойства любой соли в молекулярном и ионном виде. Понимать разницу между химическими свойствами средней, кислой и основной соли и написать уравнения соответствующих реакций
4) написать уравнения реакций термического разложения карбонатов, гидрокарбонатов, гидроксокарбонатов, нитратов
Тесты
Тест 1
1. Соль и щелочь образуются при взаимодействии растворов
1) K2CO3 и Сa(ОH)2
2) Сa(ОH)2 и KОH
3) FeSO4 и NaОH
4) Ca(HSO3)2 и Сa(ОH)2
2. Раствор сульфата железа (II) реагирует с каждым из двух веществ:
1) HCl иH2SiО3
2) Ba(NO3)2 и KОH
3) O2 и HNO3
4) H2O и Сu(OH)2
3. При нагревании сравнительно легко разлагаются с образованием оксида кальция
1) Сa SO4 и Сa(ОH)2
2) Сa CO3 и Сa(ОH)2
3)Сa (HSO3)2 и Сa(NO3)2
4)Сa SO3 и Сa(ОH)2
4. Гидрофосфдт натрия реагирует с
1) K2CO3
2) Сa(ОH)2
3) NO
4) NaCl
5. При взаимодействии 1 моль Сu(OH)2 и 1 моль НCl образуется
1) средняя соль
2) кислая соль
3) основная соль
4) комплексная соль
6. Карбонат натрия в растворе взаимодействует со всеми веществами в ряду
1) NaCl, NaHSO4,CaCl2
2) CO2,SO3,NaH2PO4
3) CO,SO3,HCl
4) Na2SiO3,Sr(NO3)2
7. Гидроксохлорид железа (III) взаимодействует с
1) NaCl
2) MgSO4
3) NaОH
4) HCl
8. С раствором сульфата олова(II) взаимодействует
1) HCl
2)О2
3)Hg
4) BaSO4
9. Выделение углекислого газа не происходит при взаимодействии веществ:
1) NaHСO3 и HCl
2)СО и С
3)СО и NiO
4) CaСO3 и HNO3
10.Гидрокарбонат калия в растворе очищают от примеси карбоната калия, используя
1) Сa(ОH)2
2) HCl
3) ВaСO3
4) СO2
Тест 2
1. Реакция между солью и кислотой осуществима, когда взаимодействуют водные растворы:
I) KHCO3 и HCl
2) AgNO3 и HF
3) KCl (р-р) и H2SO4 (разб)
4) K2HPO4 и H3PO4
2. Реакция между солью и основанием осуществима, когда взаимодействуют:
I) CuSO4 и Ca(OH)2(р-р)
2) Ca3(PO4)2 и NaQH (р-р)
3) Ca(H2PO4)2 и KOH (р-р)
4) NaNO3 и KOH(р-р)
3. Осадок будет конечным продуктом реакции:
1) NH3 и H2SО4
2) CuSO4 и H2S (р-р)
3) СО2и Ca(OH)2 (избыток; р-р)
4) Ba(NО3)2 и Na2SO4 (р-р)
4. Между собой взаимодействуют водные растворы:
1) K3PO4 и KH2PO4
2) Na2HPO4 и NaH2PO4
3) K3PO4 и K2HPO4
4) K2HPO4 и H3PO4.
5. В водном растворе между собой НЕ взаимодействуют:
1) KHS и H2S
2) KHS и HCl
3) K2S и H2S
4) KHS и КОН
6. Дигидрофосфат аммония в водном растворе может реагировать с веществами, формулы которых:
1) NH3
2) Ba(OH)2
3) H3PO4
4) KNO3
7. Укажите формулу конечного продукта реакции между известковой водой и избытком углекислого газа:
1) CaCO3
2) (CaOH)2CO3
3) Ca(HCO3)2
4) CaC2
8. Гидрокарбонат аммония в водном растворе может реагировать с:
1) СО2
2) HCl
3) Ca(NO3)2
4) КОН
9. Укажите формулу соли, которая реагирует как со щелочами, так и сильными кислотами:
1) NaCl
2) Ca3(PO4)2
3) NaHCO3
4) K2S
10. Соль образуется при взаимодействии:
1) Al(OH)3 и КОН
2) ZnO и NaOH
3) Ca(HCO3), и Ca(OH)2
4) Ca(H2PO4)2 и H3PO4
,
Тест 3
1. Кислая соль, которая может быть образована гидроксидом железа (III) и ортофосфорной кислотой, — это:
1) Fe2(HPО3)3 3) Fе(HPО4)2
2) FeHPО4 4) Fe(H2PО4)3
2. Набор веществ, водные растворы которых можно различить с помощью лакмуса:
1) K2CO3, RbOH, NaF
2) КС1O4, Na2SO4, KNO3
3) NH4CH3COO, НС1, ZnCl2
4) MgCl2, K2S, Ba(NO3)2
3. Число разных солей, которые могут образоваться при одновременном растворении в воде углекислого газа и оксида бария, равно:
1) 1
2) 2
3) 3
4) 4
4. Формула вещества, обозначенного «X» в схеме превращений:
Fe2O3 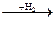 X
X 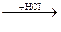 FeCl2 это:
FeCl2 это:
1) Fe 2) Fe2O3 3) Fe(OH)2 4) Fe(OH)3
5. Формулы веществ «X» и «У» в схеме превращений:
Na 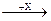 NaOH
NaOH 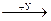 Na2SO4 соответственно
Na2SO4 соответственно
1) КОН и H2SO4 3) Н2O и SO3
2) Н2O и SO3 4) Сu(ОН)2 и H2SO4
6. В какой реакции возможно образование основной соли?
1) А1(ОН)3 + HNO3 → 3) CsOH + Н3РO4 →
2) NaOH + H2SO4 → 4) LiOH + СO2 →
7. Лакмус окрашивается в красный цвет в водных растворах всех веществ из набора:
1) КОН, MgCl2, SО2 3) А1Вr3, H2SО4, Р2О5
2) Na2CО3, NО2, NH4OH 4) NH4C1, К3РО4, НС1
8. Все три вещества — хлорид алюминия, уксусная кислота и гидроксид калия — реагируют с:
1) AgNO3 2) НВr 3) СаСO3 4) (NH4)2CO3
9. Среди следующих веществ основной солью является является:
1) (CuOH)2CO3 2) Zn(OH)2 3) Sr(HCO3)2 4) Fe(OH)2Cl
10Формулы кислоты, нормальной соли и амфотерногогидроксида соответственно:
1) NH3, CaSO4, А1(ОН)3
2) HBr, A12(SO4)3, Zn(OH)2
3) HNO3, NH4C1, Ва(ОН)2
4) H2SO4, KHCO3, Cr(OH)3
