Процессы преобразования химической энергии в электрическую энергию. гальванический элемент
МИНОБРНАУКИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Юго-Западный государственный университет»
(ЮЗГУ)
Кафедра общей и неорганической химии
УТВЕРЖДАЮ
Первый проректор –
проректор по учебной работе
_____________ Е.А. Кудряшов
«___»____________2012 г.
ОСНОВЫ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ:
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. ЭЛЕКТРОЛИЗ.
Методические указания по выполнению лабораторной работы и
для самостоятельной работы студентов технических специальностей
Курск 2012
УДК 540
Составитель: Ф.Ф. Ниязи, Е.А. Фатьянова
Рецензент
Кандидат химических наук, доцент О.В. Бурыкина
Основы электрохимических процессов: Гальванический элемент. Электролиз [Текст]: Методические указания по выполнению лабораторной работы и для самостоятельной работы студентов технических специальностей / Юго-Зап. гос. ун-т; сост.: Ф.Ф. Ниязи, Е.А. Фатьянова. Курск, 2012, 26 с.: табл. 1, прилож. 1, Библиогр.: с. 25.
Содержится краткий теоретический материал по темам: «Гальванический элемент», «Электролиз» с примерами решения задач, методики лабораторных работ по данным темам, а также контрольные вопросы и индивидуальные задания для самостоятельной работы студентов.
Предназначены для студентов технических специальности
Текст печатается в авторской рецензии
Подписано в печать 18.05.2011 Формат 60х84 1/16.
Усл.печ. л. 1,3 . Уч.-изд. л. 1,1. Тираж 100 экз. Заказ. Бесплатно.
Юго–Западный государственный университет.
305040, г. Курск, ул. 50 лет Октября, 94.
Цель работы: Уяснить понятия об потенциале металлических электродов, ряде напряжения металлов, выводы из него, принцип составления и работы гальванических элементов, расчёта их электродвижущей силы.
Уяснить сущность процессов, происходящих при электролизе. Разобрать примеры электролиза растворов электролитов, изучить законы электролиза и применять их для количественных расчётов.
ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Равновесие на границе металл-электролит, образование двойного электрического слоя. Понятие об электродном потенциале металла.
2. Стандартные потенциалы металлических электродов. Водородный электрод.
3. Ряд напряжения металлов. Понятие о восстановительной активности металлов в растворах.
4. Принцип работы гальванического элемента. Катодные и анодные процессы.
5. Зависимость электродного потенциала от концентрации ионов металла и температуры. Уравнение Нернста.
6. Зависимость величины потенциала водородного электрода от рН раствора.
7. Понятие концентрационных гальванических элементов.
8. Электродвижущая сила гальванического элемента. Способы её определения.
9. Сущность электролиза. Электролиз расплавов электролитов.
10. Закономерности протекания электролиза растворов электролитов.
11. Особенность процессов, протекающих при электролизе растворов на растворимом аноде.
12. Составление схем электролиза (катодные и анодные процессы при нерастворимых и растворимых анодах).
13. Законы Фарадея, их использование для количественных расчётов.
Электрохимия – это наука, исследующая процессы превращения энергии химической реакции в электрическую и, наоборот, электрической в химическую энергию. Преобразование химической энергии в электрическую происходит в гальванических элементах. Электрическая энергия переходит в химическую в процессе электролиза.
ПРОЦЕССЫ ПРЕОБРАЗОВАНИЯ ХИМИЧЕСКОЙ ЭНЕРГИИ В ЭЛЕКТРИЧЕСКУЮ ЭНЕРГИЮ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
В системе, состоящей из металлического стержня, опущенного в воду, небольшое количество частиц металла в виде ионов переходит в воду. Такой переход возможен благодаря особенности металлической связи и структуры кристаллической решётки металлов. В узлах кристаллической решётки металла находятся атомы и ионы металла.
Ме ↔ Меn+ + nē
Диполи воды взаимодействуют с ионами металла, образуя вокруг них гидратную оболочку. Это приводит к ослаблению связей с другими частицами внутри кристаллической решетки металла и способствует перемещению гидратированных катионов металла в жидкую фазу.
Меn+ + m H2O ↔ Меn+ . m H2O
При этом тонкий приповерхностный слой раствора заряжается положительно, а поверхность металла за счёт некомпенсированных электронов заряжается отрицательно. На границе раздела двух фаз возникает двойной электрический слой. Его электрическое поле препятствует перемещению катионов металла от поверхности пластинки по всему объёму воды.
Переход гидратированных ионов металла в воду или раствор является обратимым. Параллельно с гидратацией и переходом ионов в жидкую фазу идут процессы дегидратации, восстановления металла из раствора на поверхности металлической пластинки.
Меn+. m H2O + nē ↔ Ме + m H2O
На границе металла и раствора устанавливается равновесие данных процессов.
Для всех металлов, погружённых в воду, металлический электрод заряжается отрицательно, а приповерхностный слой – положительно. В случае когда металлическая пластинка опущена в раствор, содержащий ионы металла пластинки, равновесие, установившееся на поверхности пластины, смещается сторону реакции перехода ионов металла на поверхность пластины. При этом металл заряжается менее отрицательно.
Разность потенциалов, возникающая между металлом и раствором, называется равновесным электродным потенциалом.
Определить абсолютное значение электродного потенциала невозможно. В связи с этим измеряют разность потенциалов между данным электродом и электродом сравнения. В качестве электрода сравнения используют стандартный водородный электрод, потенциал которого условно принимают равным нулю.(рис. 1)
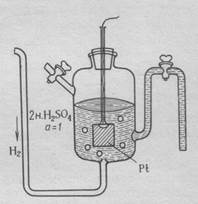
Рис.1. Строение стандартного водородного электрода
Водородный электрод состоит из платиновой пластинки, покрытой слоем губчатой платины, погружённой в раствор 2 н. серной кислоты. Через раствор кислоты пропускают газообразный водород под давлением 1 Атм.
Водород, контактируя с платиной, распадается на атомы, которые затеем адсорбируются на её поверхности.
Н2 ↔ 2Н
На границе платиновой пластины и раствора устанавливается равновесие.
Н2 ↔ 2Н+ + 2ē
В зависимости от исследуемого электрода, соединённого со стандартным водородным электродом, равновесие будет сдвигаться в сторону прямого или обратного процесса.
Электродный потенциал, измеренный в стандартных условиях (давление - 1 Атм., температура – 250С, активная концентрация ионов металла в растворе 1 моль/л), называется стандартным (φ0).
Активностью называют концентрацию электролитов, соответственно которой они взаимодействуют в реакциях. В растворе электролита каждый ион окружён ионами противоположного заряда, что уменьшает его подвижность. Вследствие этого электролиты в реакциях ведут себя так, будто их концентрация меньше действительной. В разбавленных растворах взаимодействие между ионами уменьшается, и значение активности практически совпадает с величиной молярной концентрации ионов металла.
Если расположить символы, обозначающие металлические электроды и водородный электрод, в порядке возрастания их стандартных потенциалов, получится ряд, называемый электрохимическим рядом напряжения металлов. На основания ряда напряжения металлов можно сделать выводы.
1. Металлы с более отрицательным электродным потенциалом, способны вытеснять металлы с более положительным потенциалом из водных растворов их солей. Например, Zn + CuSO4 = ZnSO4 + Cu.
 2. Металлы, имеющие отрицательный потенциал, вытесняют водород из кислот, а металлы с положительным потенциалом этим свойством не обладают. Например, Zn + 2HCl = ZnCl2 + H2; Cu + HCl =
2. Металлы, имеющие отрицательный потенциал, вытесняют водород из кислот, а металлы с положительным потенциалом этим свойством не обладают. Например, Zn + 2HCl = ZnCl2 + H2; Cu + HCl =
Прибор для измерения электродного потенциала является примером гальванического элемента.
Гальванический элемент состоит из двух электродов, соединённых между собой металлическим проводником и электролитическим ключом (или пористой перегородкой). Электролитический ключ представляет собой U – образную трубку, содержащую раствор электролита. В гальваническом элементе происходит преобразование энергии химических процессов в энергию электрическую.
Рассмотрим строение и процессы, протекающие в гальваническом элементе на примере цинково-медного гальванического элемента (Даниэля-Якоби). (рис. 2) Этот гальванический элемент состоит из цинкового и медного электродов.
Электрод представляет собой металлическую пластинку, опущенную в раствор соли данного металла, например, цинковый электрод состоит из цинковой пластинки, опущенной в раствор сульфата цинка, а медный электрод – из медной пластинки, опущенной в раствор сульфата меди.

Рис. 2. Цинково-медный гальванический элемент
Значение стандартного потенциал цинкового электрода меньше значения стандартного потенциала медного электрода (φ0 (Zn2+/Zn) = - 0,76 B, φ0 (Cu2+/Cu) = 0,34 B). Поэтому в гальваническом элементе цинковая пластина будет заряжаться отрицательно, а медная - положительно. Электроны будут перемещаться от цинкового электрода к медному. На цинковом электроде будут преобладать процессы окисления цинка:
Zn ↔ Zn2+ + 2ē;
на медном - процессы восстановления ионов меди из раствора на поверхности медной пластинки:
Cu2+ + 2ē ↔ Cu.
Электрод, в котором протекают процессы окисления, называется анодом, а электрод, на котором протекают процессы восстановления – катодом.
Потенциала анода всегда меньше потенциала катода. В гальваническом элементе анод заряжен отрицательно, катод – положительно.
Суммарный процесс протекающий на электродах выражается уравнением: Zn + Cu2+ = Zn2+ + Cu.
Схема цинково-медного гальванического элемента:
(-)Zn│ Zn2+││Cu2+ │Cu (+)
В гальваническом элементе помимо процессов окисления анода и восстановления катионов на катоде, а также перемещения электронов от анода к катоду (возникновение электрического тока), происходит направленное перемещение ионов по электролитическому ключу или через полупроницаемую мембрану от катода к аноду.
Работа гальванического элемента продолжается до полного окисления анода или полного восстановления ионов металла из раствора катода.
Характеристикой гальванического элемента является его электродвижущая сила (ЭДС, Е). Электродвижущая сила гальванического элемента – максимальное напряжение гальванического элемента, измеренное компенсационным методом, т.е. при отсутствии тока в цепи.
Следовательно, стандартный электродный потенциал есть ЭДС гальванического элемента, состоящего из стандартных исследуемого и водородного электродов.
ЭДС равна разности потенциалов катода и анода.
Ео = φо(катода) – φо(анода)
Для цинково-медного стандартного гальванического элемента ЭДС равна: Ео = φо(Zn2+/Zn) – φо(Cu2+/Cu), Ео = 0,34 - (-0,76) = 1,1 В.
На значение электродного потенциала влияют температура и концентрация ионов металла в растворе электрода. Эта зависимость выражается уравнением Нернста.
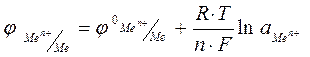 ,
,
где φ0  – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;
R - универсальная газовая постоянная, R = 8, 31 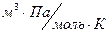 ;
;
T – температура, К;
F – постоянная Фарадея, F = 96500 Кл;
n – число электронов, участвующих в электродном процессе;
 - активная концентрация ионов металла в растворе, моль/л.
- активная концентрация ионов металла в растворе, моль/л.
Для разбавленных растворов при температуре 298 К с учётом постоянных величин, а также осуществляя переход к десятичному логарифму, уравнение Нернста приобретает вид:

Из уравнения Нернста следует, что можно изготовить гальванический элемент, состоящий из двух одинаковых электродов, отличающихся только концентрацией ионов металла или водорода в растворе. Такие элементы получили название концентрационных. Например, гальванический элемент состоит из двух никелевых электродов, концентрация ионов никеля в одном электроде 1 моль/л, в другом – 0,5 моль/л. При этом на аноде будет происходить окисление никелевой пластинки и переход ионов никеля в раствор, а на катоде - восстановление ионов никеля из раствора.
Уравнение Нернста для определения потенциала водородного электрода (рН2 = 1 Атм.) приобретает вид:  , учитывая, что рН = -lg a (H2), то формула приобретает вид
, учитывая, что рН = -lg a (H2), то формула приобретает вид 
Уравнение Нернста можно использовать для определения ЭДС гальванического элемента.
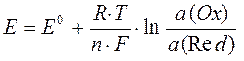 ,
,
где а (Ox) – активность ионов металла катода, моль/л,
а (Red) - активность ионов металла анода, моль/л,
ЭДС цинково-медного гальванического элемента можно определить по уравнению:

