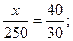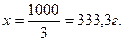Направление смещения равновесия
Пример. В каком направлении сместится равновесие в системах
а) СО (г.) + Cl2 (г.) ↔ СОСl2 (г.),
б) Н2 (г.) + I2 (г.) ↔ 2 HI (г.),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
Решение. а) Протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципа Ле-Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции.
б) Протекание реакции не сопровождается изменением числа молей газов и не приводит, следовательно, к изменению давления. В этом случае изменение давления не вызывает смещения равновесия.
Задачи для самостоятельного решения
93. В каком направлении произойдет смещение равновесия при изменении давления в системах:
а) 2NO + O2 ↔ 2NO2; б) 4HCl + O2 ↔ 2H2O + 2Cl2; в) H2 + S ↔ H2S?
94. В каком направлении произойдет смещение равновесия при
повышении температуры систем;
а) COCl2 ↔ СO + Cl2; ∆H0 > 0;
б) 2CO ↔ СO2 + C; ∆H0 < 0;
в) 2SO3 ↔ 2SO2 + O2; ∆H0 > 0;
95 В какую сторону сместится равновесие обратимых реакций:
а) PCl5 ↔ PCl3 + Cl2; ∆H0 =129,6 кДж;
б) N2 + O2 ↔ 2NO; ∆H0 =179,7 кДж;
в) N2 + 3H2 ↔ 2NH3; ∆H0 =-91.9 кДж;
г) CO + H2O ↔ CO2 + H2; ∆H0 =-41,8 кДж;
при повышении температуры? При повышении давления?
96. Сместится ли равновесие при сжатии следующих химических систем:
а) H2 + J2 ↔ 2HJ;
б) 2CO + O2 ↔ 2СO2;
в) 2SO2 + O2 ↔ 2SO3 ;
г) CO + H2O ↔ H2 + CO2?
97. Как надо поступить для того, чтобы при данной концентрации исходных веществ максимально повысить выход SO3 по реакции
2SO2+O2↔2SO3; ∆H0 = - 188,1 кДж?
98. Рассчитать, как изменятся скорости прямой и обратной реакции при увеличении давления вдвое в системах Н2 + J2 ↔ 2HJ и 2NO + O2 ↔ 2NO2, в какую сторону сместится равновесие?
99. В какую сторону сместится равновесие при повышении температуры в системах
а) N2 + 3H2 ↔ 2NH3; ∆H0 = -91,9 кДЖ;
б) N2O4 ↔ 2NO2; ∆H0 = -56,8 кДЖ;
в) 2CO + O2 ↔ 2CO2 ; ∆H0 = 568 кДЖ;
г) N2 + O2 ↔ 2NO; ∆H0 =-180,7 кДж;
100. Как повлияет на состояние равновесия в системе 4HCl + O2 ↔ 2H2O + 2Cl2 ∆H0 < 0 повышение давления и температуры?
101. В какую сторону сместится равновесие реакций
а) 2H2S ↔ 2H2+ S2; ∆H0 = 41,8 кДж;
б) CO + H2O ↔ CO2 + H2 ; ∆H0 = 41,8 кДж;
а) при понижении температуры; б) при повышении давления?
102. Как отразится повышение давления на равновесии в системах:
а) 2H2 (г) + O2 (г) ↔ 2H2O (г);
б) CO2 (г) + C(k) ↔ 2CO (г);
в) CaCO3 (k) ↔ CaO(k) + CO2 (г) ?
103. Как повлияет на смещение равновесия реакций
а) 2H2 + O2 ↔ 2H2O ; ∆H0 > 0;
б) N2 + O2 ↔ 2NO; ∆H0 < 0;
а) повышение температуры; б) уменьшение давления?
104. В какую сторону сместится равновесие при повышении давления в системах:
а) PCl5 ↔ PCl3 + Cl2; N2 + 3H2 ↔ 2NH3;
б) 2NO2 ↔ 2NO + O2; 2NO2 ↔ N2O4;
в) HJ ↔ H2 + J2; N2 + O2 ↔ 2NO?
105. В каком направлении сместится равновесие в системе
4HCl + O2 « 2Cl2 +2H2O (∆H0 < 0) при
а) повышении температуры
б) повышении давления (все вещества находятся в газообразном состоянии)
в) как следует изменить температуру и давление, чтобы максимально сместить равновесие вправо?
Варианты заданий
| Но-мер вари-анта | Номер задачи | Но-мер вари-анта | Номер задачи | ||||||||
Список рекомендуемой литературы:
1. Глинка Н.Л., Ермаков А.И. Общая химия: учебное пособие для ВУЗов
/под ред. А.И. Ермакова-29 изд., исправ.-М.: Интеграл-Пресс-2004.-728 с.
2. Глинка Н.Л.Задачи и упражнения по общей химии.-М.:Интеграл-пресс, 2006. 240с.
3. Коровин М.В. Общая химия. М.: В.Ш.- 2006. -482 с.
Задание № 4
по теме: «Растворы»
ПРОЦЕНТНАЯ КОНЦЕНТРАЦИЯ
Примеры решения задач
Пример 1.
а) Определите массовую долю (%) хлорида калия в растворе, содержащем 0,053 кг KCl в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение:
Массовая доля ω или С% показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля - безразмерная величина, ее выражают в долях единицы или процентах:
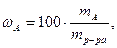
где ωA - массовая доля (%) растворенного вещества;
mA- масса растворенного вещества, г;
mр-ра – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ
m=ρV, тогда 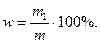
Массовая доля хлорида калия в растворе равна:
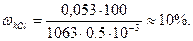
Пример 2 Какой объем раствора азотной кислоты с массовой долей HNO3 30% (ρ=1180кг/м3) требуется для приготовления 20 л 0,5 М раствора этой кислоты?
Решение:
Сначала определяем массу азотной кислоты в 20 л 0,5 М раствора:
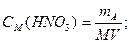
M (HNO3)=63,01 г/моль;
mHNO3=0,5∙63,01∙20=630,1 г.
Определим в каком объеме раствора с массовой долей HNO3 30% содержится 630,1 г HNO3 :
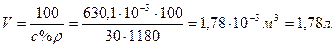
Следовательно , чтобы приготовить 20 л 0,5 М HNO3, надо израсходовать всего 1,78 л раствора азотной кислоты с массовой долей HNO3 равной 30%.
Пример 3 Какую массу раствора с массовой долей КОН 20 % надо прибавить к 250 г раствора с массовой долей КОН 90 %, чтобы получить раствор с ωКОН=50 %?
Решение:
Задача решается с помощью правила смешения. Массу раствора с массовой долей КОН 20 % обозначим через х.
Тогда 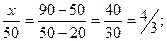 3х=1000; х=333,3.
3х=1000; х=333,3.
Для получения раствора с массовой долей КОН 50 % необходимо к 250 г раствора КОН с ω=90 % прибавить 333,3 г раствора КОН с 20 %.
Задачи такого типа решают с помощью диагональной схемы или «правила креста»: точкой пересечения двух отрезков прямой обозначают свойства смеси, которую необходимо получить.
 20 (90-50)=40
20 (90-50)=40
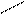
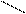

 50
50
 90 (50-20)=30
90 (50-20)=30
Массы исходных растворов, необходимые для приготовления смеси, обратно пропорциональны разностям между концентрациями заданного и менее концентрированного раствора и более концентрированного и заданного растворов: