Биологически важные ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов (азота, кислорода, серы). К биологически важным гетероциклам относятся азотсодержащие пяти- и шестичленные циклические соединения с одним или двумя атомами азота, а также их конденсированные аналоги.
Пиррол и его производные
Пиррол – пятичленный цикл с одним атомом азота. Неподеленная пара электронов гетероатома (азота) включены в сопряжение с p-электронами двух двойных связей, перераспределяя электронную плотность, поэтому легко вступает в реакции электрофильного замещения по a-углеродным атомам:
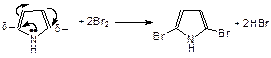
Из-за того, что пара электронов азота втянута в кольцо, связь N–H ослаблена и пиррол проявляет кислотные свойства:
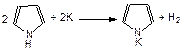
Пиррольные кольца входят в состав макроциклической системы – порфина. Восемь атомов водорода четырех пиррольных циклов могут замещаться на углеводородные заместители, образуя порфирины. Порфирин в крови образует комплексное соединение с двухвалентным железом, которое называется гемом. Гем в свою очередь связан координационной связью с глобином (белком, состоящим из аминокислот, большой молекулярной массы). Так построен гемоглобин, который входит в состав крови и выполняет функцию переноса кислорода в организме.
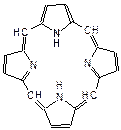 | 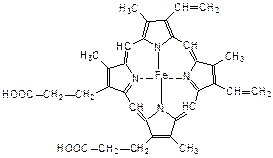 |
| порфин | гем |
Порфиновое кольцо содержится также в хлорофилле – зеленом пигменте растений, при участии которого растения поглощают из атмосферы углекислый газ, превращая его в кислород и углеводы:
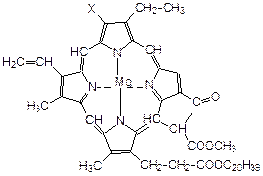
хлорофилл (Х = СН3 или СНО)
Продукт гидрирования пиррола называется пирролидин:
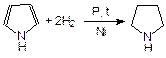
Конденсация бензольного кольца к молекуле пиррола приводит к образованию бензпиррола или индола. Из производных индола важнейшим является аминокислота триптофан, 3-(3-индолил)-2-аминопропановая кислота:
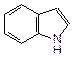 | 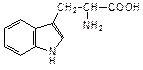 |
| индол | триптофан |
Имидазол и его производные
Имидазол – пятичленный цикл с двумя атомами азота в положениях 1 и 3. Один из атомов азота проявляет основные, а другой – кислотные свойства, поэтому имидазол амфотерен:
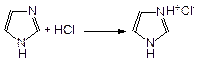
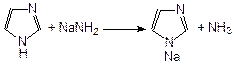
Одним из важнейших природных производных имилдазола является аминокислота гистидин (3-[4(5)-имидазолил]-2-аминопропановая кислота), которая содержится в белке крови. При повышенной температуре или ферментативном разложении гистидин декарбоксилируется и превращается в гистамин (2-[4,5-имидазолил]-1-аминоэтан):
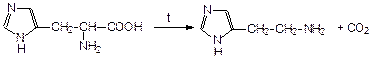
Гистидин гистамин
Гистамин обладает физиологическим действием. Он резко понижает кровяное давление и расширяет капилляры. При накапливании гистамина в организме возникают побочные явления – аллергия.
Пиридин и его производные
Пиридин является важнейшим шестичленным гетероциклом с одним атомом азота. В связи с тем, что пара электронов азота не участвует в сопряжении с p-электронами кольца, пиридин является основанием, более сильным, чем анилин, но более слабым, чем алифатические амины:
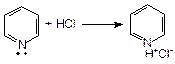
Производное пиридина – никотиновая кислота (b-карбоксипиридин) и ее амид, являются витамином РР. Он входит в состав некоторых растений.
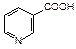 | 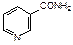 |
| никотиновая кислота | никотинамид |
Пиридиновое кольцо входит также в состав витамина В6, который представляет собой смесь трех веществ: пиридоксаля (2-метил-3-гидрокси-4-формил-5-гидроксиметилпиридин), пиридоксола (2-метил-3-гидрокси-4,5-дигидроксиметилпиридин) и пиридоксамина (2-метил-3-гидрокси-4-аминометил-5-гидроксиметилпиридин):
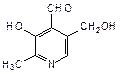 | 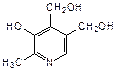 | 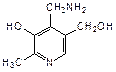 |
| пиридоксаль | пиридоксол | пиридоксамин |
Азотсодержащие гетероциклические соединения, выделяемые из растений и обладающие физиологическим действием, называются алкалоидами. Например, из 12 алкалоидов табака основным является никотин (3-(N-метил-2-пирролидил)пиридин):
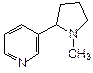
Никотин – сильный яд, поражающий мозг и нервную систему и повышающий кровяное давление. При его окислении, в том числе и в организме человека, получается никотиновая кислота.
При гидрировании пиридина образуется пиперидин:
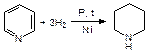
Конденсированная система пиридина и бензола – хинолин (бензопиридин). Пиридиновое кольцо в нем более ароматично, чем бензольная, поэтому общая p-связь в большей степени принадлежит пиридиновому кольцу. В результате положения 5 и 8 хинолина увеличивают активность в реакциях электрофильного замещения:
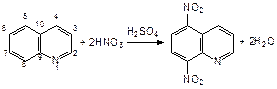
Хинолиновый фрагмент входит в состав некоторых лекарственных средств и хинолиновых алкалоидов, важнейшим из которых является хинин ((6-метокси-4-хинолил)-(5’-винил-2’-хинуклидил)-метанол):
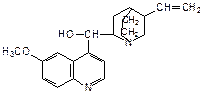
Хинин содержится в коре хинного дерева, применяется для лечения малярии.
Пиримидин и пуриновые основания
Примером азотсодержащего гетероциклического соединения с двумя атомами азота является пиримидин. Пиримидиновые циклы входят в состав нуклеиновых кислот, связанных с синтезом белка в клетках. При гидролизе нуклеиновых кислот, находящихся в ядре клетки, образуются три важных производных пиримидина (пиримидиновые основания): урацил (2,6-дигидроксипиримидин), тимин (5-метил-2,6-дигидрокси-пиримидин) и цитозин (6-амино-2-гидроксипиримидин):
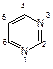 | ||
| пиримидин | ||
 | 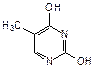 | 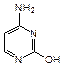 |
| урацил | тимин | цитозин |
Важным свойством пиримидиновых оснований является кето-енольная (лактим-лактамная) таутомерия, основной в растворах и кристаллическом состоянии является кетонная форма:
лактим (енол) 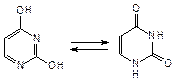 лактам (кетон)
лактам (кетон)
Наряду с пиримидиновыми основаниями в состав нуклеиновых кислот входит пурин – конденсированная система пиримидина и имидазола. Непосредственно в построении нуклеиновых кислот принимают участие пуриновые основания аденин (6-аминопурин) и гуанин (2-амино-6-гидроксипурин).
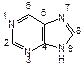 | 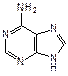 | 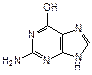 |
| пурин | аденин | гуанин |
Пуриновые и пиримидиновые основания играют огромную роль в обмене веществ в организме. В соединении с моносахаридом (рибозой или дезоксирибозой) и фосфорной кислотой они образуют нуклеотиды, из которых построены нуклеиновые кислоты (ДНК и РНК):
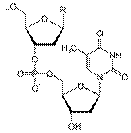 | Фрагмент полимерной цепочки дезоксирибонуклеиновой кислоты (ДНК) |
Производные пурина входят также в состав алкалоидов (кофеин, теофиллин и теобромин), токсинов (например, сакситоксин) и других родственных соединений (мочевая кислота):
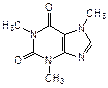 | 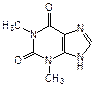 | 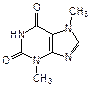 |
| кофеин (алкалоид кофе и чая) | теофиллин (алкалоид чая) | теобромин (алкалоид какао) |
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1.В.И. Слесарев. Химия. Основы химии живого. Санкт-Петербург: Химиздат, 2005 г. 783 с.
2.Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.: Медицина, 1991 г. 527 с.
3.А.В. Иванов, Н.Н. Алехина, Н.Д. Стемпинь. Курс биоорганической химии. Тула: изд-во ТГПУ им. Л.Н. Толстого, 1999. 238 с.
4.http://ru.wikipedia.org/
5.http://www.xumuk.ru/encyklopedia/2/3099.html
С О Д Е Р Ж А Н И Е
| Стр. | |
| Введение….………………………………………………. | |
| Теория химического строения органических соединений………………………………………………. | |
| Номенклатура органических соединений…………… | |
| Типы реакций в органической химии……………….. | |
| Углеводороды……………………………………… | |
| Алканы……………………………………………………. | |
| Циклоалканы……………………………………………. | |
| Алкены…………………………………………………… | |
| Алкадиены……………………………………………….. | |
| Алкины……………………………………………………. | |
| Ароматические углеводороды (арены)………………. | |
| Органические соединения с функциональными группами…………… | |
| Амины…………………………………………………..… | |
| Спирты……………………………………………………. | |
| Одноатомные предельные спирты……………………. | |
| Одноатомные непредельные спирты…………………. | |
| Многоатомные предельные спирты………………….. | |
| Фенолы……………………………………………………. | |
| Альдегиды и кетоны……………………………………. | |
| Карбоновые кислоты…………………………………… | |
| Аминокислоты, пептиды и белки…………………….. | |
| Сложные эфиры. Жиры. Липиды…………………….. | |
| Углеводы…………………………………………………. | |
| Серосодержащие органические соединения………… | |
| Биологически важные гетероциклические соединения……………………………………….………. | |
| Список использованной литературы………………… |
