Свойства одноатомных спиртов и фенолов
Глава 11. Спирты фенолы и простые эфиры.
Спирты и простые эфиры, формально можно считать производными воды, где или один из водородов замещен на органический радикал (спирты и фенолы), или оба водорода замещены (простые эфиры).
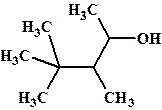 Номенклатура: для спиртов приставка окси- окончание -ол. Пример:
Номенклатура: для спиртов приставка окси- окончание -ол. Пример:
3,4,4-триметилпентанол-2 или 3,4,4-триметилпентан-2-ол или 2-окси-3,4,4-триметилпентан (в обоих вариантах названий не учитывается оптическая изомерия )
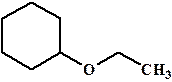 Для простых эфиров перечисляются заместители при кислороде и прибавляется слово эфир. Пример: Этилциклогексиловый эфир
Для простых эфиров перечисляются заместители при кислороде и прибавляется слово эфир. Пример: Этилциклогексиловый эфир
Для большинства ароматических спиртов и некоторых простых эфиров принято использовать тривиальные названия:
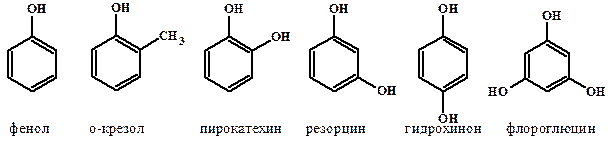
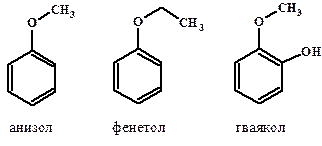
Кроме того, спирты дополнительно подразделяются на одноатомные (молекула содержит одну группу -ОН), двухатомные и многоатомные (содержат две и более -ОН групп соответственно). Простейшим двухатомным спиртом является этандиол-1,2 (этиленгликоль), а трехатомных – пропантриол-1,2,3 (глицерин).
Также спирты подразделяют по степени замещенности атома углерода, с которым связана гидроксильная группа – первичные, вторичные и третичные. Эта дополнительная градация используется, потому что химические свойства спиртов в зависимости от замещенности сильно отличаются.
Получение спиртов:
1. Кислотно-катализируемая гидратация алкенов (см. главу 6)
2. нуклеофильное замещение галогена в галогеналканах (см. главу 10)
3. Восстановление соединений содержащих карбонильную функцию металлокомплексными гидридами (LiAlH4, NaBH4), водородом на катализаторах (металлах платиновой группы) или активными металлами (система Na/этиловый спирт – восстановление по Буво-Блану).
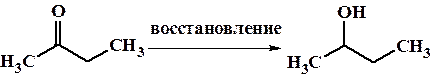
Данный тип реакций будет подробно рассмотрен в теме “карбонильные соединения”.
4. Реакция карбонильных соединений с реактивами Гриньяра (получение и свойства реактивов Гриньяра см. главу 10)
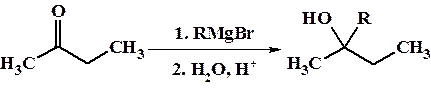
5. Синтез диолов окислением алкенов перманганатом калия или тетраоксидом осмия (см. главу 6).
6. Синтез полиолов восстановлением сахаров и их проиводных.
7. Синтез фенолов сплавлением ароматических хлоридов или бромидов со щелочью.
8. Синтез фенола каталитическим окислением кумола (промышленный метод получения). Промежуточно образующийся гидропероксид кумола подвергается внутримолекулярной перегруппировке с образованием фенола.
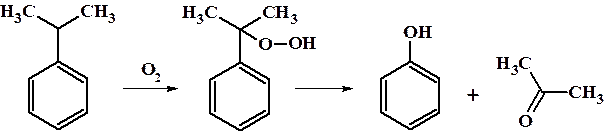
В качестве второго продукта образуется ацетон, который широко используется в промышленности и в быту как растворитель.
Свойства одноатомных спиртов и фенолов
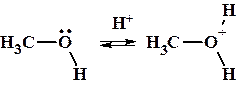
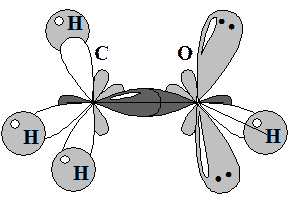 1. Атом кислорода в спиртах формально находится в sp3 гибридизованном состоянии. Две гибридные орбитали содержат по одному неспаренному электрону. За счет этих орбиталей кислород образует ковалентные связи. На двух остальных находятся электронные пары, за счет которых кислород может выступать основанием Льюиса – донором электронной пары (На рисунке схематично представлено электронное строение метилового спирта). Под действием сильных кислот спирты, также как и вода способны протонироваться с образованием катиона оксония.
1. Атом кислорода в спиртах формально находится в sp3 гибридизованном состоянии. Две гибридные орбитали содержат по одному неспаренному электрону. За счет этих орбиталей кислород образует ковалентные связи. На двух остальных находятся электронные пары, за счет которых кислород может выступать основанием Льюиса – донором электронной пары (На рисунке схематично представлено электронное строение метилового спирта). Под действием сильных кислот спирты, также как и вода способны протонироваться с образованием катиона оксония.
Одна из электронных пар кислорода в фенолах сопрягается с π-электронной системой ароматического кольца. Это приводит во первых к обогащению кольца электронной плотностью (гидроксильная группа заместитель I-го рода) и во вторых ослаблению основных и усиление кислотных свойств ОН- группы.
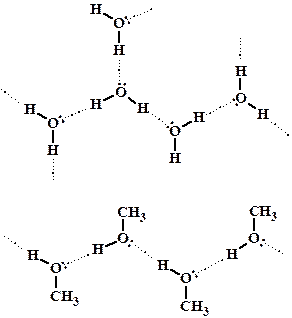 2. Спирты, как и вода, способны образовывать межмолекулярные водородные связи за счет частичного отрицательного заряда на атоме кислорода одной молекулы (одна из неподеленных пар электронов кислорода) и частичного положительного заряда на водороде другой. На рисунке схематично показано направление водородных связей в воде (плоскостная структура) и метиловом спирте (цепочечная линейная структура). За счет образования водородных связей, по сравнению с углеводородами и галогенпроизводными, спирты обладают более высокими температурами кипения при равной молекулярной массе, однако проигрывают воде по причине невозможности образования пространственных структур.
2. Спирты, как и вода, способны образовывать межмолекулярные водородные связи за счет частичного отрицательного заряда на атоме кислорода одной молекулы (одна из неподеленных пар электронов кислорода) и частичного положительного заряда на водороде другой. На рисунке схематично показано направление водородных связей в воде (плоскостная структура) и метиловом спирте (цепочечная линейная структура). За счет образования водородных связей, по сравнению с углеводородами и галогенпроизводными, спирты обладают более высокими температурами кипения при равной молекулярной массе, однако проигрывают воде по причине невозможности образования пространственных структур.
3. Спирты и фенолы проявляют слабые О-Н кислотные свойства. Способность веществ диссоциировать по кислотному типу определяется поляризацией связи О-Н и наведением на атоме водорода частичного положительного заряда. По Бренстеду обычные алифатические спирты более слабые кислоты, чем вода, а фенолы, наоборот, проявляют более выраженные кислотные свойства. То есть, рКа воды меньше чем у алифатических спиртов и больше чем у фенолов).
Константа диссоциации Ка является отношением произведения молярных концентраций образовавшихся при диссоциации частиц к общей концентрации вещества в растворе.
Ка= c(RO-)c(H+)/c(ROH)
 Кислотность спиртов зависит от электронного влияния заместителей при атоме углерода связанном с ОН- группой. Донорные заместители, за счет уменьшения поляризации связи О-Н, снижают кислотность, акцепторные – повышают. По этой же причине фенол – более сильная кислота в водном растворе рКа=9,8 (рКа=-lgКа), чем вода (рКа=15,7) за счет частичного стягивания электронной плотности с неподеленной пары атома кислорода сопряженной с ароматической системой.
Кислотность спиртов зависит от электронного влияния заместителей при атоме углерода связанном с ОН- группой. Донорные заместители, за счет уменьшения поляризации связи О-Н, снижают кислотность, акцепторные – повышают. По этой же причине фенол – более сильная кислота в водном растворе рКа=9,8 (рКа=-lgКа), чем вода (рКа=15,7) за счет частичного стягивания электронной плотности с неподеленной пары атома кислорода сопряженной с ароматической системой.
Введение акцепторных заместителей ароматическое ядро усиливает кислотные свойства фенолов, и, например пикриновая кислота (2,4,6-тринитрофенол) является сильной кислотой рКа=0,53.
Кислотные свойства спиртов обуславливают их способность реагировать со щелочными и щелочноземельными металлами с образованием солеподобных алкоголятов. Алкоголяты щелочных и щелочноземельных металлов проявляют свойства сильных оснований (боле сильных чем гидроксиды щелочных металлов).

4. Замещение спиртовой группы на галоген.
Третичные спирты реагируют в основном по механизму SN1, поэтому сильных нуклеофилов или активации субстрата не требуется. Для облегчения гетеролитической диссоциации субстрата используют протонные растворители с высокой диэлектрической проницаемостью. Данные растворители за счет неспецифической сольватации обоих образующихся ионов понижает общую энергию активации процесса.
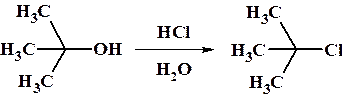
Реакцию замещения проводят при как можно более низкой температуре, для уменьшения скорости конкурирующей реакции элиминирования.
Для первичных и вторичных спиртов, как правило, реализуется механизм SN2. Гидроксильная группа является «плохой» уходящей группой. поэтому реакция замещения по механизму SN2 идет с большим трудом. Для облегчения протекания процесса часто группу ОН модифицируют, например толуолсульфохлоридом или метансульфохлоридом. Образующийся тозилат или мезилат соответствующего спирта гораздо легче и в более мягких условиях подвергается нуклеофильному замещению за счет понижения энергии переходного состояния. Кроме этого склонную к окислению и элиминированию гидроксильную группу можно «защищать» с помощью вышеперечисленных групп, с последующим высвобождением свободного спирта под действием водных кислот.
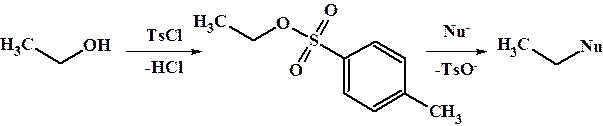
При использовании в качестве галогенирующих реагентов хлоридов или бромидов фосфора и серы также происходит промежуточная модификация уходящей группы.

Следует еще раз отметить, что при реализации механизма SN2 из оптически-активного спирта образуется также хиральный алкилгалогенид, только с обращением конфигурации.
Добиться сохранения конфигурации можно используя в качестве хлорирующего агента хлористый тионил в растворе диоксана. За счет неподеленной пары электронов кислорода диоксан хорошо сольватирует промежуточный хлорсульфонат, способствует его диссоциации с образованием ионной пары и одновременно частично блокирует возможную нуклеофильную атаку с тыла.
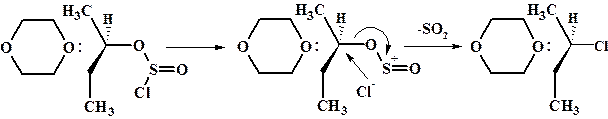
Такой механизм называют SNi. Он является частным случаем мономолекулярного механизма SN1.
5. дегидратация спиртов (Механизм Е1) протекает под действием концентрированных кислот (серной или фосфорной) при нагревании. На первой стадии сильная кислота протонирует ОН- группу, чем резко облегчает ее гетеролитический отрыв. Далее, при условии отсутствия сторонних нуклеофилов, образующийся карбокатион выбрасывает Н+ и образуется кратная связь. Отщепление воды в общем случае подчиняется правилу Зайцева, однако в смеси в большей или меньшей степени всегда присутствует изомерный алкен.

В более мягких условиях из первичных спиртов под действием концентрированных кислот образуются простые эфиры по механизму SN1. В частности, так получают диэтиловый эфир (поэтому его и называют «серный эфир». так как он получается из этанола под действием концентрированной серной кислоты). В качестве атакующего нуклеофила в этой реакции выступает непротонированная форма спирта. Вторичные и третичные спирты в этих условиях, как правило, дают только алкены.

5. Окисление спиртов.
Первичные спирты при окислении в мягких условиях (K2Cr2O7 водный раствор) образуют альдегиды, а в более жестких условиях (кислый раствор KMnO4) – карбоновые кислоты.
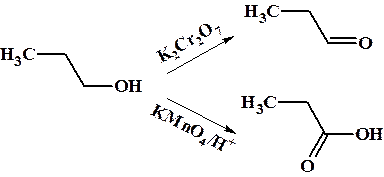
Вторичные спирты при окислении большинством окислителей образуют кетоны.
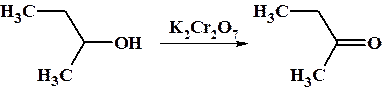
Третичные спирты устойчивы к окислению и реагируют только в очень жестких условиях с частичным разрушением углеродного скелета.
7. Синтез простых эфиров по Вильямсону представляет собой нуклеофильное замещение галогена в алкилгалогениде алкаголят ионом выступающим в роли нуклеофила.
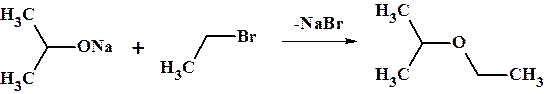
Кроме всех вышеперечисленных реакций, важное место в химии спиртов и фенолов занимает реакция этерификации – реакция с карбоновыми кислотами с образованием сложных эфиров. Подробно механизм и условия протекания реакции этерификации будут разобраны в главе 13 «карбоновые кислоты и их производные».
В природе спирты встречаются в составе древесины – метиловый спирт (древесный спирт), этанол является продуктом жизнедеятельности некоторых микроорганизмов, например, дрожжей. Последние, на ряду с этиловым продуцируют и другие спирты линейного и разветвленного строения. В состав восков и камедей входят высшие насыщенные и ненасыщенные спирты и их сложные эфиры с жирными кислотами. Среди душистых веществ (изопреноидов) также достаточно много разнообразных гидроксилсодержащих молекул. В связанном состоянии в виде сложных эфиров карбоновых кислот в жирах присутствует глицерин.
 Фенолы гораздо беднее представлены в живой природе. Так сам фенол и его простейшие аналоги являются достаточно сильными антисептиками, поэтому не совместимы с жизненными процессами. Однако, одна из незаменимых аминокислот – тирозин содержит в молекуле фенольный фрагмент.
Фенолы гораздо беднее представлены в живой природе. Так сам фенол и его простейшие аналоги являются достаточно сильными антисептиками, поэтому не совместимы с жизненными процессами. Однако, одна из незаменимых аминокислот – тирозин содержит в молекуле фенольный фрагмент.
Что касается простых эфиров, то связь С-О-С встречается в несметном количестве самых разнообразных биологических объектах, относящихся к разным классам природных соединений.
