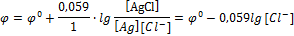Водородная шкала электронных потенциалов
Значение потенциала нельзя определить по абсолютной величине. Поэтому потенциалы всех электродов определяют по отношению к эталонному электроду сравнения, потенциал которого принимают равным нулю. В настоящее время за эталон принят потенциал стандартного водородного электрода (рис 6.3). Стандартный водородный электрод состоит из сосуда с 1н раствором кислоты, в которую опущен платиновый электрод, покрытый губчатой платиной, контактирующий с газообразным водородом, находящимся под давлением Р = 101,3 кПа. Платина практически не принимает участия в электродных реакциях и играет роль губки, пропитанной атомарным водородом.Платина используется вследствие ее инертности, а также потому, что она является катализатором переноса электрона (процесс установления равновесия ускоряется, но само состояние равновесия, то есть функции DН, DU, DG, DS, остается неизменными при постоянной температуре).
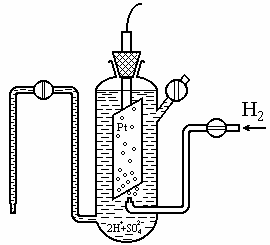
Рис. 6.3. Стандартный водородный электрод
На электроде устанавливается равновесие:
2Н+ + 2  → Н2.
→ Н2.
Потенциал водородного электрода воспроизводится с очень высокой точностью, поэтому водородный электрод и принят в качестве эталона сравнения.
В соответствии с уравнением электродного процесса n = 2, [Ox] = [H+]2, [Red] = [H2].
[Н2] пропорциональна его парциальному давлению 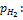
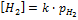
k = const, включая ее в значение j0, получим:
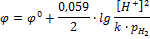
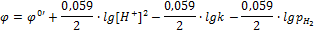
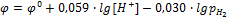
Если 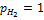 , то
, то 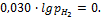
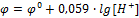
Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют ЭДС данной системы. Т.к. значение потенциала стандартного вороного электрода рано нулю, та все измеренное напряжение будет равно потенциалу измеряемого электрода.
Для того чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалов и обозначаются j0. Они часто называются также окислительно-восстановительными или редокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.
Знак конкретного j0 соответствует заряду электрода по отношению к стандартному водородному электроду.
Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма):
Ox + n 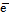 = Red.
= Red.
Эти системы в таблицах расположены в порядке возрастания величин их потенциалов, что соответствует падению восстановительной и росту окислительной активности. Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом.
Для металлов по химическим данным (Н.Н. Бекетовым), а затем путем измеренияj0 установлен ряд активности металлов, который в настоящее время имеет названиеэлектрохимический ряд напряжения металлов.
Стандартные электродные потенциалы j0 некоторых металлов
| Электрод | j0, В | Электрод | j0, В | Электрод | j0,В |
| Li+/Li | -3,045 | Mn2+/Mn | -1,18 | 2H+/H2 | 0,000 |
| Rb+/Rb | -2,925 | Cr2+/Cr | -0,913 | Sb3+/Sb | +0,20 |
| K+/K | -2,924 | Zn2+/Zn | -0,763 | Bi3+/Bi | +0,215 |
| Сs+/Cs | -2,923 | Cr3+/Cr | -0,74 | Cu2+/Cu | +0,34 |
| Ba2+/Ba | -2,90 | Fe2+/Fe | -0,44 | Сu+/Cu | +0,52 |
| Ca2+/Ca | -2,87 | Сd2+/Cd | -0,403 | Hg22+/2Hg | +0,79 |
| Na+/Na | -2,714 | Сo2+/Co | -0,27 | Ag+/Ag | +0,80 |
| Mg2+/Mg | -2,37 | Ni2+/Ni | -0,25 | Hg2+/Hg | +0,85 |
| Al3+/Al | -1,70 | Sn2+/Sn | -0,136 | Pt2+/Pt | +1,19 |
| Ti2+/Ti | -1,603 | Pb2+/Pb | -0,127 | Au3+/Au | +1,50 |
| Zr4+/Zr | -1,58 | Fe3+/Fe | -0,037 | Au+/Au | +1,70 |
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
1. чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;
2. металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
3. каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
Типы электродов
Электроды, участвующие в составлении гальванических элементов и электролитических ячеек делятся на четыре вида.
1. Металлические электроды или электроды I рода – состоят из металла, погруженного в раствор одноименных ионов. Превращению в них подвергается не только раствор электролита, но и материал электрода.
| Men+ Me |
Рис. 6.4. Схема металлического электрода
При погружении металла в раствор собственных ионов устанавливается равновесие:
Me 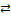 Men+ + n
Men+ + n  .
.
[Ox] = [Men+], [Red] = [Me] = const
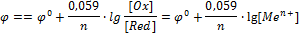
Среди металлических электродов можно выделить амальгамные электроды. Амальгама– это раствор металла в ртути. Электроды подобного типа используют для металлов химически активных, те которые в чистом виде химически взаимодействуют с водой. Например, кадмиевый амальгамный электрод Cd(Hg)/CdSO4. Реакция
Cd - 2  → Cd2+
→ Cd2+
При расчетах используют уравнение Нернста в общем виде
2. Газовые электродысостоят из проводника первого рода, контактирующего одновременно с газом и раствором, содержащем ионы одноименные газу. Проводник первого рода служит для повода и отвода электронов и является катализатором электродной реакции. Проводник первого рода не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, поэтому они чаще всего используются для создания газовых электродов. Т.к. в равновесных электродных процессах участвуют газообразные компоненты, то электродные потенциалы зависят от парциальных давлений газов. Примерами таких электродов являются водородный и кислородный электрод.
Рассмотрим кислородный электрод:
O2, Pt | OH-
O2 + 2H2O +4  → 4OH-
→ 4OH-
[Ox] = [O2]·[H2O]2= p(O2)·[H2O]2, [Red] = [OH-]4
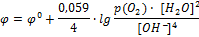
Т.к. концентрация воды в реакции практически не меняется, то ее считают величиной постоянной, ее влияние вносят в значение стандартного потенциала:
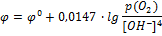
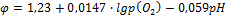
Потенциал кислородного электрода принимает положительные значения с увеличением давления кислорода и уменьшением pH.
3. Окислительно-восстановительные электроды (Red-Ox электроды).
Любая электродная реакция является окислительно-восстановительной, Red-Ox электродами относят только те электроды, в реакциях которых не принимают участия металлы и газы. Такие электроды состоят из проводника первого рода, контактирующего с раствором, содержащим окислители и восстановители. К проводникам первого рода предъявляются те же требования, что и в газовых электродов. В качестве примера окислительно-восстановительного электрода можно привести систему
Fe3+ +  → Fe2+.
→ Fe2+.
[Ox] = [Fe3+], [Red] = [Fe2+]
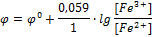
В более сложных окислительно-восстановительных процессах могут принимать участие ионы ОН- и Н+. В этих случаях потенциал электрода также будет зависеть от рН раствора. Например, для системы
MnO4- + 8H+ + 5  Mn2+ + 4H2O
Mn2+ + 4H2O
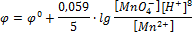
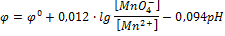
4.Электроды II рода состоят из проводника первого рода (металла) покрытого тонким слоем труднорастворимой соли этого металла, погруженного в раствор электролита с одноименным анионом.
| Cl- |
| Cl- |
| Cl- |
| Cl- |
| Cl- |
| Cl- |
| Ag AgCl |
Рис. 6.5. Схема хлор-серебряного электрода
На данном (рис 6.5) электроде проходит процесс:
AgCl +  → Ag0 + Cl-
→ Ag0 + Cl-
[Ox] = [AgCl], [Red] = [Ag]·[Cl-]