Глава 3. Химия переходных металлов
d- и f- металлы расположены в больших периодах между s- и p- элементами, т.е. осуществляют переход между типичными металлами и типичными неметаллами, за что их называют переходными элементами (переходными металлами, так как для них присущи свойства металлов). Это элементы побочных подгрупп (IIIВ–VIIIВ, IВ, IIВ).
Из 109 элементов периодической системы 40 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период.
Таблица 3.1.
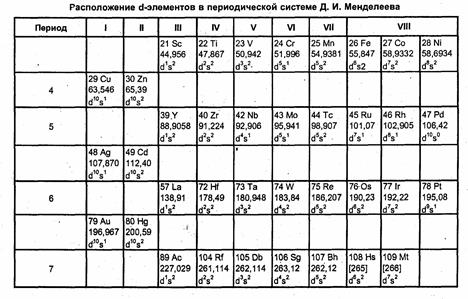
Атомы d-элементов характеризуются общей электронной формулой (n – 1)d1–10ns0–2. В образовании химической связи d-элементов участвуют валентные электроны внешнего (s-) и предвнешнего слоя (d-). При переходе к каждому последующему элементу от скандия 4s23d1 до цинка 4s23d10 идет заполнение внутреннего (3d) электронного слоя. Аналогичное явление наблюдается при переходе от Y39 (5s2 4d1) до Cd48 (5s2 4d10) и от La57 (6s2 5d1) до Hg80 (6s2 5d10).
Поэтому в периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено сближением энергий (n – 1)d- и ns-орбиталей и усилением межэлектронного взаимодействия к концу периода. Такое распределение электронов обосновано спектроскопическими данными (см. табл. 3.1).
Увеличение числа электронов иногда сопровождается немонотонностью заселения d-орбиталей. Например, для хрома (Сr24) и ванадия (V23), а так же для иридия (Ir77), платины (Pt78) происходит увеличение числа электронов на d-орбитали не на один, а сразу на два электрона. Палладий является единственным d-элементом с незаполненным s-уровнем. Это объясняется тем, что для d -элементов существует два наиболее устойчивых состояния электронов: d10- это характерно для Zn, Cd, Hg и d5 (Mn, Мо, Re). По-видимому, это является причиной «перескока» одного электрона из s-подуровня на d-подуровень.
Атомный радиус в побочных подгруппах несколько уменьшается или остается практически неизменным за счет «лантаноидного сжатия», которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения.
Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами.
В побочных подгруппах сверху вниз (кроме III В) активность металлов уменьшается, а в главных подгруппах наоборот. Например:
 подгруппа IB VIIB IIB
подгруппа IB VIIB IIB
Cu Mn Zn уменьшение металлических свойств
Ag Tc Cd усиление окислительных свойств
Au…. Re Hg возрастание энергии ионизации
Следует отметить, что у d-элементов при нарастании относительной электроотрицательности усиливаютcя кислотные и неметаллические свойства. Поэтому в периоде с увеличением атомной массы металлические свойства элементов уменьшаются (см. табл. 3.1.).
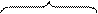

группа IV V VI VII VIII I
(3d) Ti V Cr Mn Fe Co Ni Cu
(4d) Zr Nb Mo Tc Ru Rh Pd Ag
(5d) Hf Ta W Re Os Ir Pt Au
уменьшение металлических свойств

Металлы, стоящие за лантаноидами, благодаря сжатию имеют сильно пониженную активность и большие потенциалы ионизации. Поэтому 3d-элементы по химическим свойствам (более активны) существенно отличаются от 4d- и 5d-элементов.
Так элементы 4-го периода (3d) практически все растворимы в кислотах, а элементы 5-го и особенно 6-го периодов химически инертны: тантал, вольфрам, рений, осмий, устойчивы по отношению к кислотам и растворяются лишь в смеси азотной и плавиковой кислот, расплавленных щелочах в присутствии сильного окислителя.
Как известно, восстановительная способность металла определяется не только его энергией ионизации (М – ne– → Мn+; +∆Hиониз), но и энтальпией гидратации образовавшегося катиона (Мn+ + mH2O → Мn+·mH2O; –∆Hгидр). Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны (табл. ПРИЛОЖ.).
В периоде с ростом Z восстановительные свойства металлов уменьшаются, достигая минимума у элементов IВ группы (табл.3.1.). Тяжелые металлы VIIIВ и IВ групп за свою инертность названы благородными.
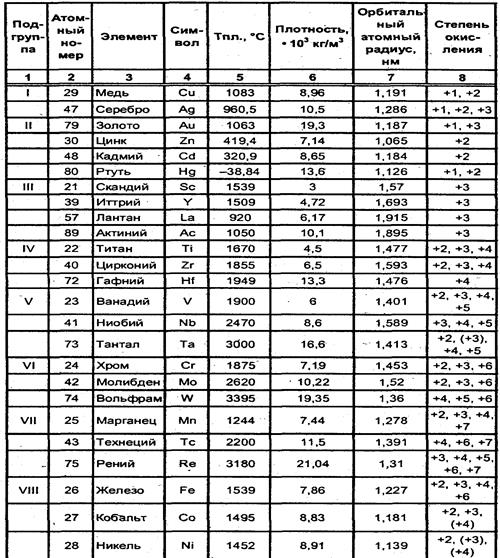
Для большинства d-элементов четвертого периода характерен большой набор валентных состояний (табл. 3.2). Поскольку часть валентных электронов находится на s-орбиталях, то проявляемые ими низшие степени окисления, как правило, равны двум. Исключение составляют элементы, ионы которых Э+3 и Э+ имеют устойчивые конфигурации d0, d5 и d10: Sc3+, Fe3+, Cu+, Ag+, Au+. В пятом и шестом периодах элементы, как правило, проявляют высшие степени окисления, равные номеру группы.
В VIIIB группе максимальная степень окисления +8 свойственна только двум элементам — рутению и осмию, например: OsO4, RuO4. У остальных элементов этой подгруппы степень окисления не превышает шести, например K2FeO4, IrF6, PtF6, для кобальта и никеля она не более трех (+3).
Из всех переходных металлов только медь, серебро и золото образуют соединения, в которых их степень окисления выше номера группы (+1,+2,+3).
Особенность элементов этого семейства в том, что им характерно как горизонтальное сходство, так и вертикальное. Например, Fe, Co, Ni (горизонтальное), Fe, Ru, Os (вертикальное), причем сходство первых выражено больше, чем вторых.
В периоде с увеличением заряда ядра наблюдается уменьшение устойчивости соединений в высшей степени окисления. Параллельно увеличиваются окислительно-восстановительные потенциалы этих соединений, например:
TiO2+| Ti3+ HVO3| VO2+ Cr2O72-|2Cr3+ MnO4-| Mn2+ FeO42-| Fe3+
0,10 0,92 1,33 1,51 1,9
усиление окислительной активности

Наибольшая окислительная активность наблюдается у феррат и перманганат ионов.
Таблица 3.2.
Основные характеристика d-элементов
В подгруппе сверху вниз устойчивость соединений в высшей степени окисления увеличивается, о чем свидетельствует характер изменения энергии Гиббса (изобарно-изотермического потенциала) однотипных соединений, например:
устойчивость соединений возрастает и одновременно уменьшаются их окислительные свойства. Например: переход CrO42-|Cr MoO42-| Mo WO42-| W Е0,В 0,366 0,154 0,049 окислительные свойства уменьшаются
Этим соединениям свойственны ковалентно-полярные связи. Они имеют кислотный характер и являются сильными окислителями (CrO3 и K2CrO4, Mn2O7 и KMnO4), а WO3, Re2O7 и соли соответствующих им кислот (H2WO4, HReO4) восстанавливаются с трудом. Это явление связано с тем, что при увеличении главного квантового числа в пределах одной подгруппы происходит уменьшение разности энергий (n – 1)d- и ns-подуровней. На кислотно-основные свойства оксидов и гидроксидов d-элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p-элементов. Соединения d-элементов в зависимости от степени окисления делят на три группы и изменение свойств их соединений можно представить так:
Например: МоО Мо2О3 МоО3
основ. амф. кисл.
В пределах одной подгруппы гидроксиды и оксиды d-элементов одинаковой степени окисления характеризуются увеличением основных свойств, при движении сверху вниз. Например, в
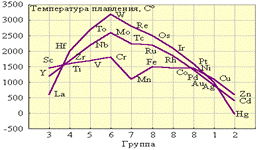
La(OH)3 – сильное основание Zr(OH)4 основных Hf(OH)4 свойств амфотерные Надо отметить, что гидроксиды некоторых d-элементов в высшей степени окисления могут также проявлять амфотерные свойства. Например, это элементы подгруппы IVВ, VВ, IIВ. В связи с неустойчивостью катионов с большим зарядом при взаимодействии оксидов и гидроксидов металлов со степенью окисления +4 и +6 с кислотами образуются соли со сложными катионами, например, ТiО2+ (титанил), VO2+ (ванадил), MoO22+ (молибденил). В периоде кислотные свойства усиливаются: Ti(ОН)4 – HVO3 – H2CrO4 – HMnO4- H2FeO4. Особенности d-элементов. Для d-элементов нет четкой зависимости изменения химических свойств от зарядов атомов в пределах данной группы, как это наблюдается для s- и p- металлов. Вследствие незаполненности d-оболочек и наличия близких по энергии незаполненных ns- и np-уровней, d-элементы склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны. У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу (тогда как у щелочных и щелочноземельных металлов валентные электроны полностью отданы в коллективное пользование). Остальные d-электроны участвуют в образовании направленных ковалентных связей между соседними атомами. Таким образом, эти элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы (рис.3.1).Из рис. 3.1. видно, что наиболее тугоплавки металлы VВ и VIВ подгрупп. У них заполняется электронами половина d-подуровня и реализуется максимально возможное число неспаренных электронов, а следовательно, наибольшее число ковалентных связей. Дальнейшее заполнение приводит к уменьшению числа ковалентных связей и падению температур плавления.
| |||||||||||||||||||||||||||||||||||
| Рис.3.1. Температура плавления d-элементов. |
d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
Отличительной особенностью переходных элементов является образование фаз переменного состава. Это, во-первых, твердые растворы внедрения и замещения и, во-вторых, соединения переменного состава.
Твердый раствор представляет собой смешанный кристалл, решетку которого образуют частицы двух или более веществ, размещенных друг относительно друга неупорядочно.
Растворы замещения образуются при замене одних частиц в узлах кристаллической решетки другими, кристаллические решетки компонентов однотипны, близок размер частиц, химические свойства (Au-Ag).
Растворы внедрения образуются при проникновении меньших по размеру частиц в междоузлия кристаллической решетки, образованной более крупными частицами (железо-углерод).
Твердые растворы образуются элементами с близкими электро-отрицательностями, атомными радиусами и одинаковыми кристаллическими решетками. Чем больше отличаются элементы по своей природе, тем менее они растворяются друг в друге и тем более склонны к образованию химических соединений. Такие соединения могут иметь как постоянный, так и переменный состав. В отличие от твердых растворов, в которых сохраняется решетка одного из компонентов, для соединений характерно образование новой решетки и новых химических связей. Другими словами, к химическим соединениям относят лишь те фазы переменного состава, которые резко отличаются по строению и свойствам от исходных.
Природа связи в таких соединениях определяется степенью заполнения d-орбиталей металла. Электроны внедренного неметалла заселяют вакантные d-орбитали, что приводит к усилению ковалентности связей. Именно поэтому доля металлической связи в соединениях начальных элементов d-рядов (IV–V групп) понижена.
Наличие ковалентной связи в них подтверждается большими положительными энтальпиями образования соединений, более высокими твердостью и температурой плавления, меньшей электропроводностью по сравнению с образующими их металлами.
Гидриды d-элементов – темные порошки или хрупкие кристаллы с высокой электро- и теплопроводностью. Это соединения переменного состава с общей формулой MH1–x, MH3–x, где x меняется в широких пределах, например, в гидридах металлов IV подгруппы — TiH1,7, ZrH1,9, TaH0,8. Элементы IV, V подгрупп и частично VIII (элементы семейства железа, а также палладий и платина) образуют гидриды внедрения, в которых атомы водорода находятся между атомами металлической решетки. Исключение составляет Pd, для которого известно соединение PdH0,59–0,60 (Pd4H3).
Металлы, с заполненным d-подуровнем (Cu, Ag, Zn, Cd) с водородом не взаимодействуют.



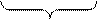 MnO MnO2 MnO3 и Mn2O7
MnO MnO2 MnO3 и Mn2O7
 группа IIIВ IVВ
группа IIIВ IVВ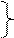 Sc(OH)3 – слабое, Ti(ОН)4 усиление
Sc(OH)3 – слабое, Ti(ОН)4 усиление