Периодичность физических и химических свойств элементов. Энергия ионизации, сродство к электрону, электроотрицательность, атомный радиус
С увеличением порядкового номера элемента или заряда его ядра периодически изменяются атомные радиусы, энергия ионизации., сродство к электрону , электроотрицательность элементов и степень ок. элементов.
Периодически изменяются хим. св-ва окисления, основные металлические, не металлические, окисл-вост.
энергия ионизации зависит от: заряда ядра, орбитальный радиус фактора, степень заполнения электрона данного энергетического слоя, эффект экранирования, эффект проникновения.
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
Электроотрицательность – это способность атома в молекуле илим фазе к оттягиванию на себя электронов от других атомов.
Атомный радиус — радиус, характеризующий приблизительный размер атома. С увеличением атомного номера элемента Атомный радиус уменьшается, поскольку возрастает заряд ядра.
11. Химическая связь и строение молекул. Энергия и длинна связи. Ковалентная связь и её свойства. Спин-валентность свободных атомов в основном и возбужденных состояниях (на примерах элементов 11 периода).
Химическую связь можно определить как взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая многоатомная микросистема (молекула, кристалл, комплекс и др типы св.: атомная, ионная, металлическая, водородная.
Молекулой называется наименьшая частица вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями.
Атомом называется наименьшая частица вещества, обладающая всеми химическими свойствами данного химического элемента. В состав атома входят положительно заряженное ядро и электроны, движущиеся в электрическом поле ядра. Заряд ядра по абсолютной величине равен суммарному заряду всех электронов атома. Электронными орбитами в атоме называются геометрические места точек, в которых с наибольшей вероятностью может быть обнаружен электрон. Простейшим атомом является атом водорода, состоящий из одного протона в ядре и одного электрона, движущегося в кулоновском электрическом поле ядра. Атомы инертных газов часто называют одноатомными молекулами.
Устойчивость молекулярного состояния зависит от температуры, давления и других внешних факторов. При достаточно высоких температурах молекулы всех газов распадаются на атомы.
Если молекула состоит из нескольких одинаковых или близких по строению групп атомов, то ее называют макромолекулой. Ионом называется электрически заряженная частица, которая образуется при потере или приобретении атомом или молекулой одного или нескольких электронов.
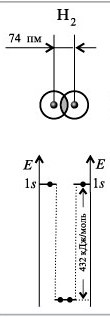
В большинстве случаев - чем больше энергия связи, тем меньше длина связи. Зависимость энергии одинарной связи между идентичными атомами элементов 2-го и 3-го периодов от ПЭИ связываемых атомов и выражается гиперболой. С ростом порядкового номера элемента ковалентный радиус его атома возрастает , а длины соответствующих связей увеличиваются, изменение гибридизации орбиталей атома ведет к изменению его ковалентного радиуса
Энергия химической связи,равна работе, которую необходимо затратить, чтобы разделить молекулу на две части (атомы, группы атомов) и удалить их друг от друга на бесконечное расстояние.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков.
особенности ков. св.:насыщаемость, близкодействие, направленность в состав с типом гибридизации.
спинвалентность- возможность образования связи за счет неспаренных электронов.
12. метод валентных связей. Гибридные орбитали и связи. Валентные углы. Строение молекул BeF2, BeF3, CCl4, SF6, H2O и NH3.
ВАЛЕНТНЫХ СВЯЗЕЙ МЕТОД (метод валентных схем), метод приближенного решения электронного ур-ния Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами. Осн. физ. идея валентных связей метода состоит в том, что волновая ф-ция молекулы выражается через волновые ф-ции составляющих ее атомов
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
ОРБИТАЛЬ– область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Валентный угол — угол, образованный направлениями химических связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путем анализа их вращательных спектров (смотри Инфракрасная спектроскопия, Молекулярные спектры, Микроволновая спектроскопия). Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
13. Кратность (порядок) связи. сигма- и Пи-связи, схемы перекрывания атомных орбиталей и прочность связей. Полярные связи и молекулы.
КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи.
σ-связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии соединяющей ядра атома
π-Связь– ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Если соединение образуется между двумя различными неметаллами, то такое соединение называетсяковалентной полярной связью.
ПОЛЯРНЫЕМОЛЕКУЛЫ, молекулы, обладающие постоянным дипольным моментом в отсутствие внеш. электрич. поля. Дипольный момент присущ таким молекулам, у к-рых распределение электронного и ядерного зарядов не имеет центра симметрии. Обычно полярность отдельных фрагментовмолекулы или хим. связей между двумя атомами (или большим числом атомов) определяется величиной соответствующего дипольного момента: чем он больше, тем сильнее полярность.
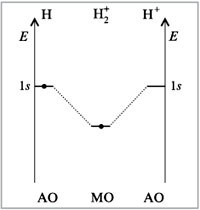
14. Представление о методе молекулярных орбиталей. Связывающие, разрыхляющие и несвязывающие орбитали. Энергетические диаграммы образования молекул H2, H2+, He2+.
Метод мол. орбиталей позволяет дать более детальную на электронном уровне классификацию вкладов в энергию взаимодействия молекул.
В методе МО предполагают, что в молекуле, как и в атоме, можно построить набор разрешенных дискретных энергетических уровней и соответствующих им волновых функций (молекулярных орбиталей), описывающих поведение электрона в молекуле. На каждом энергетическом уровне может располагаться не более двух электронов.
В связывающей молекулярной орбитали электронная плотность концентрируется между ядрами, в разрыхляющей молекулярной орбитали — за ядрами, а между ними она равна нулю. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участия в образовании химической связи не принимают. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают).