Криоскопические и эбулиоскопические константы
Некоторых растворителей
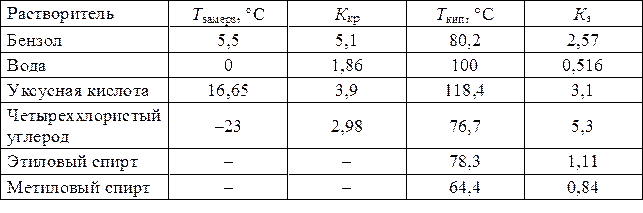
Пример 7.Раствор, содержащий 1,7 г ZnCl2 в 250 г воды, замерзает при -0,23 °С. Определить кажущуюся степень диссоциации хлорида цинка в этом растворе.
Решение. Вычисляем понижение температуры замерзания данного раствора DТзамерз = 0 - (-0,23) = 0,23; 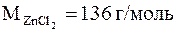 . По формуле (7.13) с учетом (6.5) находим изотонический коэффициент:
. По формуле (7.13) с учетом (6.5) находим изотонический коэффициент:
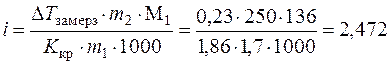 ,
,
используя формулу (7.11), получаем 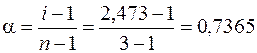 , или 73,65 %.
, или 73,65 %.
Пример 8. Определить температуру кипения водного раствора едкого кали, содержащего в 100 г воды 14 г KOH. Кажущаяся степень диссоциации KOH равна 60 %.
Решение. Определим изотонический коэффициент по формуле (7.10) i = 1 + (2-1)×0,6 = 1,6. Моляльность раствора найдем по формуле (6.5): 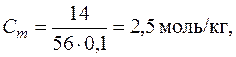 где 56 г/моль – молярная масса KOH. Для воды Кэ = 0,516. Повышение температуры кипения раствора определим по формуле (7.14):
где 56 г/моль – молярная масса KOH. Для воды Кэ = 0,516. Повышение температуры кипения раствора определим по формуле (7.14):
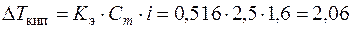 °С.
°С.
Температура кипения раствора следующая: 100 + 2,06 = 102,06 °С.
Пример 9. Осмотическое давление 0,1 н. ZnSO4 при 0 °С равно 1,59×105 Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Решение. Концентрация раствора ZnSO4 (в моль/л) равна 0,05, или 50 моль/м3. Из уравнения (7.15) для растворов электролитов найдем изотонический коэффициент:
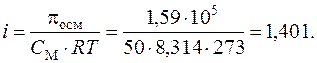
Соль ZnSO4 диссоциирует на два иона (n = 2). Согласно формуле (7.11) 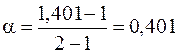 или 40,1 %.
или 40,1 %.
Пример 10. Определить концентрацию раствора глюкозы, если при 18 °С он изотоничен с раствором, содержащим 0,5 моль/л CaCl2. Кажущаяся степень диссоциации хлорида кальция в растворе составляет 65,4 %.
Решение. Согласно формулам (7.15) 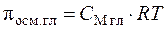 ,
, 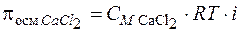 . Растворы изотоничны, т. е. имеют одинаковое осмотическое давление:
. Растворы изотоничны, т. е. имеют одинаковое осмотическое давление: 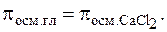 При диссоциации CaCl2 n = 3; a = 0,654, тогда по формуле (7.11) i = 1 + (n - 1) × a = 1 + (3 - 1) × 0,654 = 2,308, следовательно,
При диссоциации CaCl2 n = 3; a = 0,654, тогда по формуле (7.11) i = 1 + (n - 1) × a = 1 + (3 - 1) × 0,654 = 2,308, следовательно, 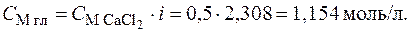
ЗАДАЧИ*
7.1. В каком случае эффективнее происходит распределение ионов электролита в этиловом спирте или в воде; в этиловом спирте или глицерине? Почему?
7.2. Определить теплоты гидратации 1 моля нитрата натрия и 1 моля гидроксида натрия и сравнить устойчивость гидратированных ионов.
Ответ: -732,2 кДж/моль; 933,1 кДж/моль.
7.3. Определить теплоты гидратации 1 моль сульфата аммония и 1 моль соляной кислоты и сравнить устойчивость гидратированных ионов.
Ответ: -1762 кДж/моль; 1461 кДж/моль.
7.4. Определить теплоту гидратации 1 моль гидроксида магния и 1 моль хлорида магния и сравнить устойчивость гидратированных ионов.
Ответ: -2975 кДж/моль; -2657 кДж/моль.
7.5. Написать уравнения диссоциации следующих соединений: KOH, H2SiO3, Al2(SO4)3, HF. Для слабых электролитов привести выражения констант диссоциации.
7.6. Написать уравнения диссоциации следующих соединений: Al(OH)3, CH3COOH, Fe(OH)2NO3, HI. Для слабых электролитов привести выражения констант диссоциации.
7.7. Написать уравнения диссоциации следующих соединений: H3PO4, RbOH, (NH4)2CO3, KHS. Для слабых электролитов привести выражения констант диссоциации.
7.8. Написать уравнения диссоциации следующих соединений: H2SeO4, NH4OH, FeCl3, HNO2. Для слабых электролитов привести выражения констант диссоциации.
7.9. Написать уравнения диссоциации следующих соединений: NaOH, H2S, NaHSO3, CuCl2. Для слабых электролитов привести выражения констант диссоциации.
7.10. Написать уравнения диссоциации следующих соединений: FeCl2, H2CO3, KHSO4, NH4OH. Для слабых электролитов привести выражения констант диссоциации.
7.11. Написать уравнения диссоциации следующих соединений: CrOH(NO3)2, CsOH, H2SiO3, ZnBr2. Для слабых электролитов привести выражения констант диссоциации.
7.12. Написать уравнения диссоциации следующих соединений: Ba(OH)2, H2Se, KAl(SO4)2, K2HPO4. Для слабых электролитов привести выражения констант диссоциации.
7.13. Во сколько раз уменьшится концентрация ионов водорода, если к одному литру 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Ответ: в 169 раз.
7.14. Вычислить степень диссоциации и концентрацию ионов водорода в 0,1 М растворе масляной кислоты.
Ответ: 1,22 %, 1,2×10-3 моль/л.
7.15. Во сколько раз [H+] в растворе муравьиной кислоты больше, чем в растворе уксусной кислоты той же концентрации?
Ответ: в 3,17 раза.
7.16. При какой концентрации (в моль/л) фтороводородной кислоты 95 % ее находится в недиссоциированном состоянии?
Ответ: 0,288 моль/л.
7.17. Вычислить a и [H+]: а) в 0,3 М растворе хлорноватистой кислоты HOCl и б) в 0,01 М растворе этой же кислоты.
Ответ: a) 0,06 %, 1,7×10-4 моль/л; б) 1,73 %, 1,7×10-4 моль/л.
7.18. Рассчитать степень диссоциации уксусной кислоты в 1 М растворе. Как изменится a, если этот раствор разбавить в 10 раз?
Ответ: 0,42 %; увеличится в 3,15 раза.
7.19. Вычислить осмотическое давление морской воды при 27 °С, если ее состав (в г/л) следующий: NaCl – 27,2; MgCl2 – 3,4; MgSO4 – 2,3; CaSO4 – 1,3; KC1 – 0,6. Кажущаяся степень диссоциации указанных солей равна единице.
Ответ: 2,77×106 Па.
7.20. Осмотическое давление 0,05 М раствора электролита 2,72×105 Па при 0 °С. Кажущаяся степень диссоциации электролита в растворе 70 %. На сколько ионов диссоциирует молекула электролита?
Ответ: на 3 иона.
7.21. Какова концентрация (в % мас.) физиологического раствора поваренной соли, применяемого для внутривенного вливания, если этот раствор изотоничен с плазмой крови, осмотическое давление которой равно 7,6×105 Па при нормальной температуре человеческого тела 37 °С? Считать, что соль полностью диссоциирована, плотность раствора соли принять равной 1 г/см3.
Ответ: 0,86.
7.22. Вычислить концентрацию водного раствора мочевины, если раствор при 27 °С изотоничен с 0,5 М раствора CaСl2. Кажущаяся степень диссоциации в 0,5 М СаС12 – 65,4 %.
Ответ: 1,154 моль/л.
7.23. Раствор, содержащий 0,05 моль сульфата алюминия в 100 г воды, замерзает при -4,19 °С. Определить кажущуюся степень диссоциации соли в растворе.
Ответ: 87,2 %.
7.24. Имеются растворы, содержащие в равных массах воды: первый – 0,25 моль сахара, второй – 0,13 моль хлорида кальция. Оба раствора кипят при одинаковой температуре. Определить кажущуюся степень диссоциации CaСl2 в растворе.
Ответ: 46,15 %.
7.25. Водный раствор, содержащий нелетучее растворенное вещество (неэлектролит), замерзает при -2,2 °С. Определить температуру кипения раствора и давление пара раствора при 20 °С. Давление пара чистой воды при 20 °С составляет 2337,8 Па.
Ответ: 2289 Па, 100,61 °С.
7.26. Вычислить температуру замерзания раствора 7,308 г хлорида натрия в 250 г воды, если при 18 °С осмотическое давление указанного раствора равно 2,1077×106 Па. Плотность раствора принять за 1.
Ответ: -1,667 °С.
7.27. Вычислить активность ионов Cu+2 и SO4-2 в 0,2 н. растворе CuSO4, содержащем, кроме того, 0,01 моль/л HCl.
Ответ: по 0,015 моль/л.
7.28. В 1 л раствора содержится 0,1 моль NaCl и 0,1 моль NaOH. Рассчитать ионную силу раствора и активность иона натрия.
Ответ: 0,2; 0,014 моль/л.
7.29. Вычислить ионную силу раствора и активность ионов: а) 0,05; М AgNO3; б) 0,003 М MgCl2.
Ответ: а) 0,05, по 0,0405 моль/л; б) ~ 0,01; 0,002 и 0,005 моль/л.
7.30. Вычислить активность ионов Ca+2 и NO3- в 0,05 М растворе Ca(NO3)2, содержащем, кроме того, 0,05 моль/л HNO3.
Ответ: 0,012, 0,105 и 0,035 моль/л.
Раздел 8. Ионное произведение воды.
Водородный показатель
Жидкая вода является сложной системой, для которой характерно образование ассоциатов (H2O)n за счет водородных связей. Вода, будучи слабым электролитом, относится к амфотерным растворителям, молекулы которых могут служить как донорами, так и акцепторами протонов H+. Она в незначительной степени диссоциирует на ионы водорода и гидроксид-ионы:
H2O « OH- + H+ (8.1)
Константа диссоциации (самоионизации) воды определяется уравнением
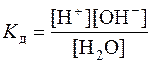 . (8.2)
. (8.2)
где в квадратных скобках указана концентрация. Более точным выражением для константы диссоциации Kд является уравнение с использованием активности ионов (ai), однако, здесь и далее будут использоваться концентрации, так как в разбавленных растворах значения концентраций и активностей совпадают.
При 25 °С константа диссоциации воды Kд = 1,8×10-16. Плотность воды равна единице, откуда получим, что в 1 л воды содержится количество воды 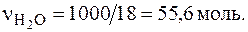 Следовательно, [H2O] = 55,6 моль/л. Тогда получим
Следовательно, [H2O] = 55,6 моль/л. Тогда получим
[H+][OH-] = Kд× [H2O] = 1,0×10-14 = Kw.(8.3)
Величина Кw, равная произведению концентраций ионов водорода и гидроксид-ионов, называется ионным произведением воды. Диссоциация воды происходит с поглощением теплоты (процесс эндотермический), поэтому с увеличением температуры Кw возрастает. При 100 °С Кw = 7,4 10-13. При обычных условиях (20–25 °С) величину Кw приближенно считают постоянной и равной 1×10-14.
Кислотность и щелочность растворов лучше всего характеризовать величиной концентрации ионов водорода и гидроксид-ионов. В 1909 г. Серензен предложил применять вместо подлинных значений [H+] и [ОH-] их отрицательные логарифмы с обратным знаком – так называемые водородный и гидроксидный показатели.
Водородный показатель pH:
pH = - lg[H+] (8.4)
гидроксидный показатель pOH:
pОH = - lg[ОH-] (8.5)
Очевидно, что при 25 °С получим
pH + pOH = 14. (8.6)
Для чистой воды pH = pOH = 7. В кислых растворах pH < 7, в щелочных pH > 7. При расчетах pH и pOH следует иметь в виду, что под знаком логарифма стоят не собственно концентрации, а равные им по значению безразмерные величины.
Измерение и регулирование величины рН среды является необходимым при проведении различных технологических процессов, оценке качества почв в сельском хозяйстве, а также при проведении исследовательских работ, особенно в области химии. Величина рН природных, грунтовых и промышленных вод является важнейшей экологической характеристикой, а также позволяет оценить вероятность процессов коррозии строительных конструкций в подобных средах. Например, при соприкосновении покрытых бетоном поверхностей с кислыми водными растворами возможно вымывание легкорастворимых солей, что приводит к разрыхлению структуры бетона. Следует подчеркнуть особую роль кислотности среды в биологии и медицине. Значения рН крови и других биологических жидкостей существенно влияют на процессы жизнедеятельности животных и растительных организмов. Величины рН биологических систем находятся в узком диапазоне значений. Например, рН крови колеблется в области 7,35–7,45; рН молока – в интервале от 6,6 до 6,9; рН слюны – в области 6,35–6,85. Отклонение от указанных пределов свидетельствует о наличии патологии в организме.
Измерение рН обычно производится потенциометрическим методом. В основе этого метода лежит определение электродвижущей силы (ЭДС) обратимого гальванического элемента, который состоит из электрода с водородной функцией, например стеклянного и электрода сравнения. Преимущества потенциометрического метода в том, что он позволяет производить измерения в мутных и загрязненных растворах и характеризуется относительной простотой приборного оформления. Основными элементами потенциометрической установки являются гальванический элемент и измерительное устройство (иономер, рН-метр), работа которого основана на использовании компенсационного метода измерения ЭДС.
Кислотность растворов можно приближенно оценить с помощью специальных реактивов – индикаторов. Индикаторы – это вещества, которые могут изменять цвет при изменении рН среды. Индикаторы представляют собой слабые кислоты или основания и отличаются тем, что их молекулярные и ионные формы имеют различную окраску. Переход от одной окраски к другой происходит в узком диапазоне рН. Свойства некоторых индикаторов представлены в табл. 9.
Таблица 9
