Ступенчатая диссоциация электролитов
Диссоциация многоосновной кислоты, имеющей, например, п атомов водорода, способных ионизироваться, протекает в п последовательных стадий:
HnA + H2O = H3O+ + Hn–1A–
H2O + Hn–1A– = H3O+ + Hn–2A2–
H2O + Hn–2A2– = H3O+ + Hn–3A3–
……………………………………
H2O + HAn–1 = H3O+ + An–
Концентрационная константа диссоциации для каждого из выше написанных уравнений равновесия будет иметь свое значение и определяться соответствующим выражением:
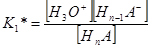
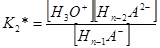
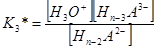
………………………………
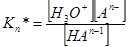
Концентрация Н2О постоянна и включена в К*.
Константы диссоциации зависят от структуры молекул кислот, причем константа диссоциации каждого последующего атома водорода меньше константы диссоциации предыдущего, т. е. K1* > > K2* > K3* > … > Kn* Значение каждой последующей константы составляет ~ 1/100000 от предыдущей. Эта закономерность является общей для тех кислородсодержащих кислот, у которых все ОН–-группы связаны с одним и тем же атомом. Например, диссоциация фосфорной кислоты протекает по схеме:
H2O + H3PO4 = H3O+ + H2PO4–
H2O + H2PO4– = H3O+ + HPO42–
H2O + HPO42– = H3O+ + PO43–
Константы диссоциации определяются следующими выражениями
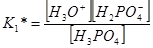
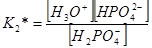
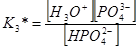
и имеют соответственно значения 5,9∙10–3; 6,2∙10–8; 4,8∙10–13.
Равновесные концентрации разных сортов частиц рассчитываютметодом, аналогичным изложенному при рассмотрении комплекс-ных ионов (см. 4.3).
Материальный баланс для фосфат-иона при диссоциации фосфорной кислоты, аналитическая концентрация которой равна С, запишется так:
[H3PO4] + [H2PO4–] + [HPO42–] + [PO43–] = C
Определим равновесные концентрации частиц из констант диссоциации и, подставляя их в уравнение материального баланса, получим:
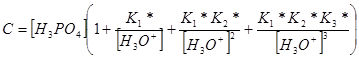
Доля кислоты, присутствующей в виде определенной формы, является отношением равновесной концентрации этой формы к аналитической концентрации, например
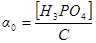
Следовательно
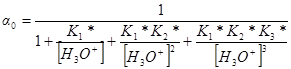
Доли других частиц будут определяться выражениями:
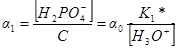
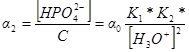
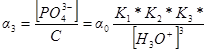
Уравнение материального баланса может быть записано также следующим образом:
α1 + α2 + α3 α0 = 1

Рис. 4,2. Распределительная диаграмма фосфорной кислоты.
Равновесные концентрации каждого сорта частиц, присутствующих при диссоциации многоосновной кислоты, рассчитываются, если известны константы
диссоциации и равновесные концентрации, кислоты и ионов водорода.
На рис. 4.2 приведена зависимость α — рН, полученная при использовании констант ионизации, приведенных выше.
Интересен тот факт, что в растворе фосфорной кислоты присутствует либо только один сорт частиц фосфорной кислоты, либо два сорта каких-либо частиц в сравнимых концентрациях, в зависимости от интервала изменения рН, но ни в одном интервале рН не находится сразу три сорта частиц.
