Устойчивость к загрязняющим примесям
Обработка бурового раствора при загрязнении цементом:
1. Увеличение концентрации дефлоккулянтов в буровом растворе. Лигносульфонат и лигнит действуют эффективно в присутствии кальция в широком диапазоне рН. При необходимости дополнительного контроля водоотдачи можно применить TANNATHIN®, RESINEX® и XP-20K™, которые весьма эффективны в среде с большим уровнем кальция. Большинство проблем, вызванных загрязнением цемента, решаются достаточно легко именно таким образом. Однако при проходке большого количества цемента буровой раствор необходимо обработать так, чтобы снизить содержание извести (если это позволит температурный режим).
2. Когда цемент становится растворимым, он повышает щелочность. Поэтому необходимости в добавлении каустической соды вместе с дефлоккулянтами нет. Низкий рН дефлоккулянтов, таких как лигнит и SAPP, компенсирует влияние гидроксил-ионов, образовавшихся при растворении цемента. Это способствует снижению pH и Pm, что повышает растворимость цемента (и кальция), в результате чего образуется осадок.
3. Свободный кальций можно осадить из раствора бикарбонатом натрия или кислым пирофосфатом натрия. Существуют разные точки зрения относительно того, какой из этих химреагентов наиболее эффективен, однако и бикарбонат натрия, и SAPP в равной степени снижают рН и Pm.
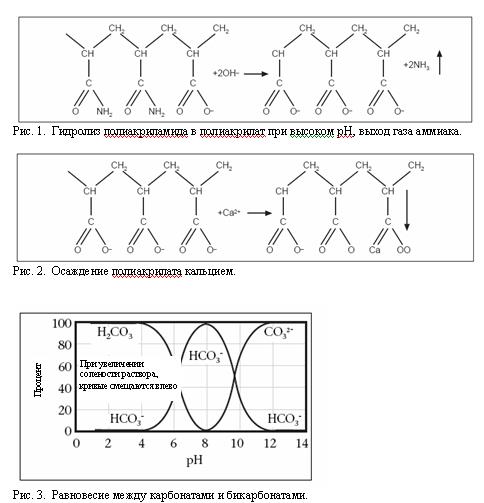
4. Если разбуривание цемента ведется на полимерном растворе, в таком растворе будет иметь место гидролизация полимеров из-за высокого рН и осаждение полимеров кальцием (см. Рис. 1 и 2). Поэтому необходимо снизить уровень рН и срочно удалить кальций (Ca2+) из раствора осаждением.
5. В этом случае в раствор вводится лимонная кислота (H3C6H5O7). Лимонная кислота осаждает цемент в виде цитрата кальция и снижает рН. Реакция при обработке раствора лимонной кислотой имеет следующий вид:
2(H3C6H5O7 •H2O) + 3Ca(OH)2 ®
Ca3(C6H5O7)2 ¯ + 8H2O
6. Еще один метод борьбы с загрязнением бурового раствора цементом – применение механических систем очистки для удаления мелких частиц цемента. В этом случае цемент удаляется еще до того, как он может раствориться при низком рН.
Рис. 1. Гидролиз полиакриламида в полиакрилат при высоком рН, выход газа аммиака.
Рис. 2. Осаждение полиакрилата кальцием.
Бикарбонат натрия – отличное средство для борьбы с загрязнением раствора, так как бикарбонат осаждает кальций и снижает уровень рН. В зависимости от рН раствора, бикарбонат натрия образует ионы карбоната (CO32–) и бикарбоната (HCO3–), которые осаждают кальций путем образованием карбоната кальция (известняка) как показано ниже:
NaHCO3 + Ca(OH)2 ® NaOH + H2O + CaCO3 ¯
При добавлении бикарбоната снижается уровень рН. Это – результат реакции HCO3 с NaOH, которая необходима для преобразования HCO3 в CO3. При использовании двууглекислого натрия целью является введение в раствор источника ионов карбоната и бикарбоната для реакции с избыточной известью и ионами кальция. Зачастую при использовании этого метода обработки раствора возникают осложнения из-за передозировки карбоната. Если концентрация карбонатов превышает уровень, необходимый для осаждения кальция, возможно загрязнение бурового раствора карбонатами. Поэтому лучше всего сперва добавить лишь небольшое количество карбонатов и понаблюдать за характеристиками раствора. Еще один подход к обработке цемента – использование фосфата SAPP (кислый пирофосфат натрия). Фосфаты хорошо удаляют кальций и способствуют дефлоккуляции загрязненного раствора. Используемые для обработки фосфаты при температуре выше ±200°F преобразуются в ортофосфаты. Ортофосфаты не так эффективны в качестве дефлоккулянтов, однако они все еще способны удалять из раствора кальций. Дополнительный эффект использования фосфатов заключается в снижении рН, Pf и Pm. У кислого пирофосфата натрия рН равен 4,8; у PHOS – 8,0.
Еще одно преимущество фосфатов заключается в отсутствии побочных продуктов реакции, которые могут привести к дополнительным осложнениям. При необходимости снижения уровня Pm лучше воспользоваться кислым пирофосфатом натрия. При проходке большого количества цемента может потребоваться обработка бурового раствора какой-либо кислотой. Даже при использовании бикарбоната уровень рН может превысить допустимые пределы, поэтому в таких случаях буровой раствор обрабатывают лимонной кислотой, кислым пирофосфатом натрия, уксусной кислотой, лигнитом с низким рН или лигносульфонатом.
Примечание: из-за высокого уровня рН кальцинированная сода при обработке загрязненного цементом раствора не применяется.
Загрязнение карбонатами
Химическое загрязнение бурового раствора растворенными карбонатами – одна из самых сложным и наименее изученных проблем нашей отрасли. В результате загрязнения карбонатами и бикарбонатами увеличивается вязкость, ДНС и СНС; такое загрязнение может привести к отвердению бурового раствора. Увеличение вязкости может наблюдаться при флоккуляции глинистых частиц раствора под действием карбонатов или бикарбонатов.
Источниками карбонатов и бикарбонатов являются:
1. Углекислый газ (СО2), попавший в буровой раствор из атмосферы через перемешиватели бурового раствора в емкостях и на выходах системы очистки и системы приготовления раствора. При растворении СО2 образуется углекислота (H2CO3), которая распадается на бикарбонаты (HCO3) и/или карбонаты (CO3) в зависимости от уровня рН раствора.
2. Передозировка кальцинированной соды или двууглекислой соды при обработке бурового раствора, загрязненного цементом или гипсом.
3. Вторжение углекислого газа (СО2) из пласта или пластовой воды.
4. Бикарбонаты или карбонаты, являющиеся побочными продуктами разложения лигносульфоната и лигнита под воздействием высоких температур (выше 325°F).
5. Барит, в котором иногда содержатся ионы карбоната или бикарбоната.
 Приведенные ниже химические уравнения иллюстрируют растворение СО2 с образованием углекислоты (H2CO3), которая затем распадается на бикарбонаты (HCO3) и/или карбонаты (CO3), в зависимости от уровня рН бурового раствора. Эти уравнения показывают обратимость химических реакций в зависимости от рН. Таким образом, СО3 может снова стать HCO3 и даже CO2 при снижении рН.
Приведенные ниже химические уравнения иллюстрируют растворение СО2 с образованием углекислоты (H2CO3), которая затем распадается на бикарбонаты (HCO3) и/или карбонаты (CO3), в зависимости от уровня рН бурового раствора. Эти уравнения показывают обратимость химических реакций в зависимости от рН. Таким образом, СО3 может снова стать HCO3 и даже CO2 при снижении рН.
CO2 + H2O ↔ H2CO3
H2CO3 + OH– ↔ HCO3 – + H2O и
HCO3–↔ OH– ↔CO32– + H2O
Графически эти реакции проиллюстрированы на Рис.3, показывающем распределение углекислоты (H2CO3), бикарбоната (HCO3) и карбоната (CO3) от уровня pH.
Рис. 3. Равновесие между карбонатами и бикарбонатами.
