Растворимость жидкостей и твердых тел в жидкостях
Растворимость твердых тел в жидкостях чаще всего с повышением температуры увеличивается. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела.
Растворимость жидкостей в жидкостях также увеличивается с ростом температуры и выше некоторой температуры, которая называется критической температурой растворения, становится неограниченной.
Однако, если энергия гидратации (сольватации) велика и образование раствора сопровождается выделением энергии, растворимость с ростом температуры понижается. Это наблюдается, например, при растворении в воде щелочей, некоторых солей лития, магния, алюминия согласно схеме
Кристалл + Растворитель « Насыщенный раствор ± Q.
Растворение жидкостей и твердых тел в жидкостях обычно не сопровождается значительным изменением объема, поэтому растворимость веществ, находящихся в жидком и твердом состоянии, практически не зависит от давления.
Растворимость твердых тел выражаюткоэффициентом растворимости – массой вещества в граммах, которую нужно растворить в 100 г растворителя при данной температуре для получения насыщенного раствора.
Пример 4.Определение растворимости вещества. Вычислить растворимость BaCl2 при 0 °С, если в 13,1 г раствора содержится 3,1 г безводной соли.
Решение. Определим массу растворителя в растворе:
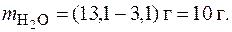
Рассчитаем коэффициент растворимости BaCl2 при 0 °С:
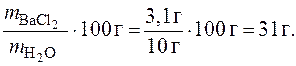
Пример 5.Определение массы растворенного вещества, кристаллизующегося из насыщенного раствора при его охлаждении. Какая масса соли выпадет в осадок из 540 г водного раствора AlCl3 при понижении температуры от 80 до 0 °С? Растворимость AlCl3 при 0 °С равна 44,9 г, а при 80 °С – 48,6 г.
Решение. Определим массу раствора (m), содержащую 100 г растворителя, при указанных температурах:
при t = 0 °C m1 = (100 + 44,9) г = 144,9 г,
при t = 80 °C m2 = (100 + 48,6) г = 148,6 г.
Определим массу соли, которая выпадает в осадок при охлаждении 148, 6 г раствора:
Dm = m2 - m1 = (148,6 - 144,9) г = 3,7 г.
Составим пропорцию и определим массу AlCl3, которая кристаллизуется при охлаждении 540 г раствора:
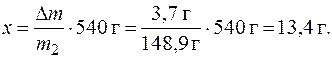
Задачи
6.32. Какой объем воды необходимо взять, чтобы полностью растворить 250 г хлора при 10 °С и давлении 1,5×105 Па? Коэффициент абсорбции хлора составляет при 10 °С и давлении 1,0133×105 Па 3,148 м3 на 1 м3 воды.
Ответ: 17,5 л.
6.33. Растворимость сероводорода при 20 °С и давлении 1,0133×105 Па равна 2,91 л на 1 л воды. Вычислить массовую долю H2S в растворе.
Ответ: 0,41 %.
6.34. Коэффициент абсорбции CO2 при 20 °С равен 0,878. Под каким давлением должен находиться диоксид углерода, чтобы при растворении его в воде получить раствор с массовой долей CO2 1 %?
Ответ: 6,3×105 Па.
6.35. В 0,05 л воды растворено 4,9 л хлороводорода при 18 °С и 1,0×105 Па. Определить массовую долю (%) HCl в полученном растворе.
Ответ: 13 %.
6.36. Коэффициент абсорбции водорода в воде при 30 °С составляет 0,017. Какова массовая доля (%) водорода в растворе при 30 °С и давлении 96500 Па?
Ответ: 0,13 %.
6.37. Газовую смесь, состоящую из 40 % об. водорода и 60 % об. диоксида углерода, растворили в воде при 10 °С и давлении 1,0133×105 Па. Определить коэффициент абсорбции газовой смеси и объемные доли H2 и CO2 в смеси, растворенной в воде. Коэффициенты абсорбции H2 и CO2 соответственно равны 0,0199 и 1,194.
Ответ: 0,724; H2 – 1 %, CO2 – 99 %.
6.38. Температура поверхностного слоя водоема изменяется в дневное время суток от 10 до 20 °С. Какой объем кислорода выделится из поверхностного слоя толщиной 10 см, если площадь водоема 500 м2? Коэффициенты абсорбции кислорода при 10 и 20 °С соответственно равны 0,038 и 0,031. Содержание кислорода в воздухе принять равным 22 % об.
Ответ: 0,077 м3.
6.39. Растворимость диоксида углерода в воде при 0 °С и давлении 1,0133×105 Па равна 1,713 м3 на 1 м3 воды. Какова масса CO2, содержащегося в 25 л H2O, при этой температуре и давлении 0,745×105 Па?
Ответ: 61,84 г.
6.40. Вычислить растворимость Ba(NO3)2 в воде при 20 °С, если в 545 г раствора этого вещества в воде при указанной температуре содержится 45 г нитрата бария.
Ответ: 9 г в 100 г воды.
6.41. Коэффициент растворимости CaCl2 в воде при 100 °С равен 159 г на 100 г H2O. Какая масса хлорида кальция при этой температуре содержится в 2 кг раствора?
Ответ: 1228 г.
6.42. Вычислить массовую долю K2SO4 и его коэффициент растворимости, если при 0 °С 50 г раствора содержат 3,44 г сульфата калия.
Ответ: 6,9 %; 7,4 г в 100 г воды.
6.43. Определить массовую долю CoCl2 и растворимость хлорида кобальта, если 500 г раствора при 20 °С содержат 173 г соли.
Ответ: 34,6 %; 52,9 г в 100 г воды.
6.44. Растворимость CuSO4 при 20 и 100 °С равна соответственно 20,2 и 77 г. Какая масса сульфата меди выпадет в осадок, если охладить 825 г раствора от 100 до 20 °С?
Ответ: 264,7 г.
6.45. Определить массу карбоната калия, выпавшего в осадок из 770 г насыщенного при 100 °С раствора, если его охладить до 0 °С. Коэффициент растворимости K2CO3 при 100 °С составляет 155 г, а при 0 °С – 111 г.
Ответ: 132,9 г.
6.46. При охлаждении насыщенного при 90 °С раствора до 25 °С выкристаллизовалось 200 г соли. Определить массу воды и соли в исходном растворе, если коэффициенты растворимости равны 42,7 и 6,9 г при температурах 90 и 25 °С соответственно.
Ответ: 556,8 г; 237,8 г.
