Задачи к контрольной работе №1
1. Напишите формулу пентапептида: Асп—Вал— Глу—Фен—Лиз. Выделите в пептиде повторяющиеся группы, образующие пептидный остов, и вариабельные группы, представленные радикалами аминокислот. Обозначьте в пептиде N- и С-концы. Подчеркните пептидные связи. Напишите все возможные пептиды, состоящие из тех же аминокислот.
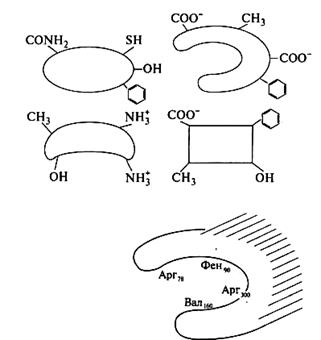
2. Решите задачу. Специфичность взаимодействия белков с лигандом обеспечивается комплементарностью структуры центров связывания структуре лиганда. В активный центр белка входят 4 аминокислотных остатка (см. схему активного центра белка).
 |
 |
 |
Ответьте на вопросы: а) какой из указанных лигандов с наибольшей вероятностью будет взаимодействовать с активным центром данного белка и почему?
б) какие типы связей возникают в процессе образования комплекса белок—лиганд, в) какой из указанных лигандов с наибольшей вероятностью может быть ингибитором функции данного белка и почему?
3. Напишите формулу гексапептида, содержащего 2 аминокислотных остатка с гидрофобными радикалами, 2- с катионными радикалами, по одному — с гидрофильными незаряженными и анионными радикалами. На рисунке: а) подчеркните пептидные связи; б) покажите пунктиром связи, возникновение которых приводит к образованию α-спирали; в) выпишите аминокислотные остатки пептида, радикалы которых могут участвовать в гидрофобных взаимодействиях (а), в образовании водородных (б) и ионных (в) связей.
4. В ядерных белках-гистонах содержится большое количество аминокислотных остатков аргинина и лизина, а в белке крови альбумине - много остатков глутаминовой и аспарагиновой кислот. Ответьте на вопросы:
а) в каких средах (>, < или =7,0) лежит ИЭТ этих белков?
б) с каким из 2 белков может взаимодействовать Са2+?
5. Определите суммарный заряд пентапептида при рН 7,0: Глу-Арг-Лиз-Вал-Асп. Как изменится суммарный заряд этого пептида: а) при рН«7,0; б) при рН »7,0. Напишите формулу данного пентапептида и все возможные пептиды, состоящие из тех же аминокислот.
6. Определите ИЭТ пептида (>, < или =7,0) Про-Лиз-Тир-Глн-Три.
Напишите формулу данного пентапептида и все возможные пептиды, состоящие из тех же аминокислот.
7. Определите ИЭТ пептида (>, < или =7,0) Ала-Сер-Глу-Асн-Мет. Напишите формулу данного пентапептида и все возможные пептиды, состоящие из тех же аминокислот.
8. Сравните направление движения в электрическом поле двух пептидов при рН 7,0 (к катоду или аноду):
а) Вал-Глу-Ала;
б) Лей—Асн—Apr. Напишите их формулы.
9. Сравните растворимость двух пептидов при рН 7,0:
Сер—Цис—Глу—Тир—Асп;Вал—Apr—Мет—Фен—Тир. Напишите их формулы.
10. Выберите методы, с помощью которых можно разделить смесь белков на индивидуальные белки; укажите физико-химические свойства белков, лежащие в основе каждого метода.
| Название белка | Молекулярная масса,Д | ИЭТ |
| Церулоплазмин γ-Глобулин β-Лактальбумин | 150 000 37 000 | 4,4 6,3 5,2 |
11. Ферменты гексокиназа и глюкокиназа катализируют одну и ту же реакцию: Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ а) Изобразите в виде графиков (в одной системе координат) зависимость скорости от концентрации глюкозы для обоих ферментов, если известно, что Km для гексокиназы составляет ~ 0,04 ммоль/л, а для глюкокиназы - ~ 10 ммоль/л.б) Отметьте на графиках Vmax и Km. Дайте определение этим величинам. Как характеризует фермент Km?в) Для какого из ферментов при одинаковой концентрации глюкозы скорость ферментативной реакции будет больше? Почему?
12. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи. 1. Сер, Асн 2. Ала, Вал 3. Глу, Асп 4. Гис, Асп 5. Цис, Ала 6. Сер, Глн.
13. Напишите пептид: Сер – Глу – Про – Лиз – Гис.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный скатионной группой
3. Гидрофильный незаряженный
4. Гидрофобный
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. С концевая аминокислота
2. Иминокислота
3. Диаминомонокарбоновая кислота
в) Какой суммарный заряд имеет данный пептид. Что такое изометрическая точка белка и в какой среде лежит ИЭТ данного пептида?
14. Напишите пептид: Глу – Apг – Тир – Асп – Мет.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный скатионной группой
3. Гидрофильный незаряженный
4. Гидрофобный
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. N концевая аминокислота
2. Аминокислота, содержащая гуандииновую группу
3. Моноаминодикарбононая аминокислота
в) Какой суммарный заряд имеет данный пептид при рН=7. Что такое изоэлектрическая точка белка, и какова ИЭТ данного пептида (>7, =7или <7)?
15. Изобразите в виде графика зависимость скорости реакции от концентрации субстрата.
а) Отметьте на графиках Vmax и Km. Дайте определение этим величинам. Как характеризует фермент Km?
б) Используя данные о зависимости скорости реакции (V) от концентрации субстрата (S), представленные в таблице, оцените приблизительно значения Vmax и Km.
| Концентрация субстрата (S) мкмоль/л | Скорость реакции (V) мкмоль/мин |
| 0,2 0,4 0,8 1,6 |
16. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи.1. Асп, Три 2.Асн, Тре 3. Apг, Лиз 4. Глу, Гис 5. Мет, Иле 6. Цис, Глн.
17. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи. 1. Асп, Лиз 2. Вал, Тре 3. Apг, Гис 4. Глу, Сер 5. Три, Иле 6.Тре, Глн.
18. Фермент сахараза может катализировать следующие реакции:
Сахараза + H2O → Глюкоза + Фруктоза
Раффиноза + H2O → Галактоза + Глюкоза + Фруктоза
а) Изобразите в виде графиков (в одной системе координат) зависимость скорости реакции, катализируемой сахарозой, от концентрации субстрата – сахарозы (Km = 0,05 ммоль/л) и раффинозы (Km = 2,00 ммоль/л), - если считать Vmax одинаковой (10 ммоль ∙ л-1 ∙ мин-1).
б) Отметьте на графиках Vmax и Km. Дайте определение этим величинам. Как характеризует фермент Km?
в) В каком случае при одинаковой концентрации субстратов (например, 0,1 ммоль/л) скорость ферментативной реакции будет больше? Почему?
19. Содержание азота в серине составляет 13,3%. Вычислите молекулярную массу серина, если известно, что в молекуле серина содержится один атом азота.
20. Лизин содержит 19,17% азота. Вычислите молекулярную массу лизина, если известно, что в молекуле лизина содержатся два атома азота.
21. Определите изоэлектрическую точку следующих аминокислот: глицина, α-аланина, β-аланина, изолейцина, саркозина и двух дипептидов: глицилглицина и глицилаланина при 25°С, зная, что значения рКа при указанной температуре соответственно равны:
| Соединение | рКаt | рКа2 |
| Глицин | 2,4 | 9,7 |
| α -Аланин | 2,34 | 9,69 |
| β -Аланин | 3,60 | 10,19 |
| Изолейцин | 2,38 | 9,68 |
| Саркозин | 2,23 | 10,01 |
| Глицилглицин | 3,06 | 8,13 |
| Глицилаланин | 3,15 | 8,25 |
22. Рассчитайте значения изоэлектрических точек глицина, аспарагиновой кислоты и лизина. Значения рКа для указанных аминокислот следующие:
| Соединение | рКаt | рКа2 | рКа3 |
| Глицин | 2,4 | 9,7 | - |
| Аспарагиновая кислота | 1,9 | 3,7 | 9,6 |
| Лизин | 2,2 | 8,9 | 10,5 |
В каких позициях от линии старта окажутся перечисленные аминокислоты после их электрофоретического фракционирования в буферной системе с рН = 6,5?
23. Смесь аминокислот, содержащая валин, лейцин, аспарагиновую кислоту, лизин, гистидин и серин, была подвергнута фракционированию методом электрофореза на бумаге при рН = 6,2. Какие из указанных аминокислот будут перемещаться к катоду, к аноду или останутся на линии старта и почему?
24. Тетрапептид содержит в своем составе аланин, лизин, пролин и валин. В результате реакции тетрапептида с динитрофторбензолом и последующего гидролиза ДНФ-пептида 6 н. раствором соляной кислоты был получен ДНФ-аланин. Гидролиз тетрапептида трипсином дает два соединения, одно из которых окрашивается нингидрином в сине-фиолетовый, а другое - в желтый цвет. Какова первичная структура тетрапептида?
25. В гидролизате пептида найдены ала, вал, глу, фен, тир, гли, лиз, лей, мет и NH3. При обработке пептида по методу Сэнджера выявлен ДНФ-аланин, карбоксипептидазой - глицин. В триптическом гидролизате обнаружено два пептида: первый состоит из вал, ала, глн, лиз, фен; второй - из мет, гли, лей, тир и при обработке по Сэнджеру дает ДНФ-лейцин. В химотриптическом гидролизате найдено три пептида: первый содержит мет, гли; второй - вал, ала, фен, глн; третий - лей, тир, лиз. Выведите на основании всей совокупности данных первичную структуру исходного пептида.
26. Высчитайте объем 0,2 М раствора гидроксида калия, необходимого для нейтрализации 200 мл 0,1 М раствора солянокислого глицина.
27. Рассчитайте объем 0,2 М раствора гидроксида калия, необходимого для титрования 200 мл 0,15 М раствора аспарагиновой кислоты, находящейся в изоэлектрической точке.
28. Раствор, содержащий триптофан и тирозин в 0,1 н. растворе гидроксида натрия, имеет оптическую плотность 0,500 при 294,5 нм и 0,700 при 280 нм (ширина кюветы 1 см). Какова концентрация этих двух аминокислот, если коэффициенты молярной экстинкции триптофана и тирозина в 0,1 н. растворе гидроксида натрия имеют следующие значения:
| Длина волны (нм) | Коэффициент молярной экстинкции | |
| триптофана | тирозина | |
| 294,5 280,0 |
29. Раствор L-лейцина (3,0 г в 50 мл 6 н. раствора HС1) имеет угол вращения +1,81° при толщине слоя жидкости 20 см. Вычислите удельное вращение [а]20D и молярное вращение (М) L-лейцина (в 6 н. растворе НС1).
30. Антитоксический псевдоглобулин лошади был подвергнут ультрацентрифугированию до и после обработки пепсином. Константы седиментации были соответственно равны 7,2×10-13 и 5,7×10-13 сек, а коэффициенты диффузии соответственно 3,9×10-7 и 5,8×10-7 см2/сек. Плотность воды при 20°С равна 0,9982. Удельный парциальный объем этого белка составляет 0,745. Как изменилась молекулярная масса псевдоглобулина после обработки его пепсином?
31. При изучении алкогольдегидрогеназы печени лошади были получены следующие данные: константа седиментации - 4,88 единиц Сведберга; коэффициент диффузии - 6,5×10-7 см2/сек, удельный парциальный объем - 0,751; плотность растворителя 0,998. Вычислите молекулярную массу фермента.
32. Изучение седиментации и диффузии альбумина человека привело к следующим показателям: s20 = 4,24×10-13 сек; D20= 6,32×10-7 см2/сек. Плотность воды при 20°С — 0,9982, а удельный парциальный объем альбумина —- 0,733. Вычислите молекулярную массу указанного белка.
33. Раствор, содержащий 0,102 г белка в 100 мл раствор обработали 2,4-динитрофторбензолом. Полученный раствор ДНК белка имеет величину оптической плотности, равную 0,5 при 360 нм. Рассчитайте молекулярную массу белка, если в тех же условиях коэффициент молярной экстинкции моно-ДНФ-белка равен 1,61×104 л/моль×см, а белок в своем составе содержит три полипептидные цепи.
34. Выведите эмпирическую и молекулярную формулы пептида, если в ходе анализа было установлено, что содержание глицина в пептиде составляет 0,3 г, аланина - 0,18 г, фенилаланина - 0,33 г. Молекулярная масса пептида равна 1050 ± 25.
35. Раствор 0,3 г полиаланина в 100 мл воды развивает осмотическое давление 7,85 мм рт. ст. при 25 °С. Рассчитайте молекулярную массу полиаланина и коэффициент поликонденсации аланина в его составе.
36. Гемоглобин содержит 0,34% железа. Высчитайте минимальную молекулярную массу гемоглобина.
37. По аналитическим данным гемоглобин лошади содержит: Fe - 0,335%, S - 0,390%; гемоглобин свиньи: Fe - 0,400%, S - 0,480%. Определите минимальные молекулярные массы гемоглобинов этих двух видов животных.
38. Содержание меди в гемоцианине, выделенном из разных видов животных, таково: рак - 0,32%, омар - 0,34%, осьминог - 0,38%, улитка - 0,29%, мечехвост - 0,173%. Рассчитайте и сравните минимальные молекулярные массы гемоцианинов разного происхождения.
39. Гемоглобин быка содержит 0,336% железа, 0,48% серы и 4,24% аргинина. Вычислите минимальную молекулярную массу гемоглобина быка, число атомов Fe и S, а также остатков аргинина в нем.
40. Молекулярная масса ДНК-полимеразы равна 109 000. Вычислите количество аминокислотных остатков в составе молекулы указанного белка.
41. Белок содержит 0,58% триптофана. Чему равна минимальная молекулярная масса этого белка?
42. Белок содержит 0,8% цистеина. Вычислите минимальную молекулярную массу этого белка.
43. Содержание триптофана, тирозина и β-оксиглутаминовой кислоты в глутелине пшеницы соответственно равно: 1,68, 4,5 и 1,8%. Используя эти данные, вычислите минимальную молекулярную массу глутелина и число остатков указанных аминокислот в его молекуле.
44. 1 г белка содержит 0,025×10- 3 мМконцевых α-аминогрупп. Вычислите минимальную молекулярную массу этого белка.
45. При определении молекулярной массы рибонуклеазы методом ультрацентрифугирования получены следующие величины: 13 100; 13 640; 13 400; 13 250; 13 790. Вычислите среднее квадратичное отклонение и среднюю ошибку опыта. Представьте данные о молекулярной массе рибонуклеазы в виде М ± т.
46. Общая кислотная емкость яичного альбумина равна 8,7×10-4 экв/г. Молекулярная масса этого белка, найденная методом диффузии и седиментации, равна 43 800. Рассчитайте число катионных групп в молекуле этого белка.
47. Сывороточный альбумин имеет общую кислотную и основную емкость 72×10-5 и 70×10-5 экв на 1 г соответственно. Молекулярная масса указанного белка равна 67 100. Вычислите число анионных и катионных групп в молекуле сывороточного альбумина.
48. Эдестин (белок семян конопли) имеет общую кислотную емкость 134×10-5 экв/г и молекулярную массу 309 000 (по данным седиментационного анализа). Рассчитайте число катионных групп в молекуле эдестина.
49. Общая кислотная и основная емкости на 1 г миогена соответственно равны 1,35×10-3 и 1,28×10-3 экв. Рассчитайте и сопоставьте минимальную массу, исходя из приведенных выше данных по титрованию этого белка.
50. Используя обозначения: К - катод, А - анод, С- линия старта, укажите направление перемещения при электрофорезе следующих белков: а) тропомиозин - в буферной системе с рН = 5,1; б) гемоглобин - рН = 4,8; в) рибонуклеаза - рН = 4,2; 9,5 и 11,3, учитывая, что изоэлектрическая точка тропомиозина - 5,1, гемоглобина — 6,8 и рибонуклеазы — 9,45.
51. При каких значениях рН наиболее целесообразно электрофоретическое фракционирование нижеперечисленных белковых смесей: а) миозина и гемоглобина; б) уреазы и гемоглобина; в) щелочной фосфатазы, сывороточного альбумина и уреазы; г) цитохрома с и гемоглобина, если изоэлектрическая точка миозина - 5,4; щелочной фосфатазы - 4,5; гемоглобина - 6,8; уреазы - 5,0; цитохрома с - 10,65.
52. Как изменится электрофоретическая подвижность белка (изоэлектрическая точка его равна 6,8, фракционирование ведется при рН = 7,0), если в его молекуле: а) глу заменен на вал; б) лиз заменен на глу; в) глу заменен на лиз; г) вал заменен на глу; д) гис заменен на арг.
53. При исследовании Ф. Сэнджером первичной структуры цепи А инсулина быка было показано, что она содержит 21 аминокислотный остаток, а именно - гли, ала, вал2, лей2, иле, цис4, асп2, глу4, сер2, тир2. Обработка полипептида динитрофторбензолом с последующим гидролизом привела к ДНФ-глицину, карбоксипептидазой - к аспарагиновой кислоте. При действии на цепь А инсулина быка пепсином были получены пептиды: глу-цис-цис-ала-сер-вал, гли-иле-вал-глу, асп-тир-цис-асп, тир-глу-лей-глу; химотрипсином - сер-лей-тир, глу-лей-глу-асп-тир, цис-асп, гли-иле-вал-глу-глу-цис-цис-ала-сер-вал-цис. Исходя из этих данных, выведите первичную структуру цепи А инсулина быка.
54. Вычислите в нанометрах длину молекулы рибонуклеазы, содержащей 124 аминокислотных остатка, если она: а) существует полностью в α-спиральной конфигурации, б) совершенно линейна, в) доля спиральной конфигурации равна 17%.
55. В клетке кишечной палочки содержится 108 молекул белка со средней молекулярной массой, равной 40 000. Вычислите общую длину всех полипептидных цепей, находящихся в одной клетке кишечной палочки, если полипептидные цепи имеют α-спиральную конфигурацию.
56. Белковая часть вируса табачной мозаики состоит из 2130 субъединиц, с молекулярной массой 17 500 каждая. Вычислите общую длину всех полипептидных цепей, если доля спиральной конфигурации в них равна 30%.
57. Лактатдегидрогеназа, строение которой изучено методом рентгеноструктурного анализа, состоит из четырех субъединиц, с молекулярной массой 35 000 каждая (311 аминокислотных остатков в субъединице). В структуре каждой субъединицы имеется 8 α-спиральных участков, содержащих в сумме 109 аминокислотных остатков. Рассчитайте степень спирализации, характерную для лактатдегидрогеназы.
58. Молекула папаина (растительная протеиназа) содержит в своем составе 211 аминокислотных остатков. Псевдокристаллическая часть молекулы папаина состоит из четырех коротких α-спиралей, каждая из которых содержит 10 аминокислотных остатков, и фрагмента полипептидной цепи из 9 аминокислотных остатков, находящегося в β-конформации. Определите количество аминокислотных остатков, составляющих аморфную часть молекулы папаина, и степень спирализации, характерную для данного белка.
59. Рентгеноструктурный анализ (разрешение 0,2 нм) показал, что в молекуле карбоксипептидазы около 30% аминокислотных остатков включены в состав α-спиралей, а 20% - сосредоточены в зоне, образованной регулярно повторяющимися складками вытянутой полипептидной цепи. Рассчитайте количество аминокислотных остатков, находящихся в аморфной части молекулы, а также в ее α-спиральной области и складчатой зоне, если общее число аминокислотных остатков в молекуле карбоксипептидазы равно 255.
60. Г. Хюфнер экспериментально определил, что 1 г гемоглобина соединяется с 1,34 мл кислорода при нормальных условиях. Гемоглобин содержит 0,335% железа. Используя эти данные, оцените молярные соотношения кислорода и железа в гемоглобине при полном насыщении его кислородом.
61. Гемоглобин взаимодействует с кислородом с образованием комплекса, в котором на 4 моль кислорода приходится 1 моль гемоглобина. Вычислите число молекул гемоглобина, необходимое для переноса 1 мл кислорода (у. н.).
62. 50 мг овальбумина (молекулярная масса 54 000) было растворено в 20 мл фосфатного буфера (рН=7,0). После обработки белка проназой рН раствора уменьшился до 6,8. Потребовалось 2,5 мл 0,01 М раствора гидроксида натрия для доведения рН раствора до 7,0. Какова молярность фосфатного буфера? Какое число пептидных связей (на 1 моль белка) распалось в результате обработки альбумина проназой ?
63. Приведите уравнение реакции, раскрывающее механизм участия убихинона в окислительно-восстановительных процессах в организме.
64. Представьте в виде схемы реакцию декарбоксилирования пировиноградной кислоты с участием тиаминпирофосфата.
65. Напишите уравнение реакции окисления витамина B1 в тиохром гексациано-(III)-ферратом калия в щелочной среде.
66. Напишите уравнение реакции перехода окисленной формы никотинамидадениндинуклеотида в восстановленную.
67. Выразите системой химических уравнений механизм реакции переаминирования аспарагиновой и пировиноградной кислот с участием пиридоксальфосфата.
68. Приведите схему переноса оксиметильной группы на глицин с участием 5,8,7,8-тетрагидрофолиевой кислоты.
69. Напишите уравнение реакции биосинтеза ацетилхолина. Приведите тривиальное название фермента, катализирующего данную реакцию, и укажите класс и подкласс, к которому он относится.
70. Напишите уравнение реакции превращения янтарной кислоты в фумаровую при участии флавопротеида (назовите фермент), и составьте схему переноса атомов водорода на убихинон и далее электронов с помощью цитохромной системы на кислород.
71. Напишите уравнение реакции синтеза пантотеновой кислоты и назовите фермент, ускоряющий этот процесс.
72. Напишите уравнения реакций декарбоксилирования лизина и щавелевоуксусной кислоты и отметьте особенности ферментов, катализирующих данные процессы.
73. Составьте схему превращений, указав ферменты, ускоряющие соответствующие этапы процесса: Аспарагин → аспарагиновая кислота →фумаровая кислота →яблочная кислот.
74. Составьте превращения в соответствии со схемой:
Глутаминовая кислота → α-кетоглутаровая кислота →янтарная кислота → фумаровая кислота →яблочная кислота.
Укажите ферменты, ускоряющие отдельные этапы реакции.
75. Дайте названия ферментам, ускоряющим превращениям:
Аргинин →орнитин →путресцин.
Укажите, к каким классам и подклассам относятся эти ферменты.
76. Молекулярная масса пируваткарбоксилазы равна 183 000. Рассчитайте молекулярную активность фермента, если известно, что его удельная активность составляет 1,2×103 E.
77. Рассчитайте удельную активность каталазы (М = 252 000) и лактатдегидрогеназы (М = 140 000), если известно, что молекулярная активность этих ферментов при температуре 25°С, оптимальном рН и полном насыщении субстратом равна 5×106 и 3,7×104 соответственно.
78. Количество распавшегося под действием каталазы пероксида водорода соответствует 14,7 мл 0,1 н. раствора перманганата калия. Вытяжка каталазы, взятая для опыта в количестве 20 мл, была приготовлена из 0,25 г моркови. Опыт проводили в течение 30 мин. Определите активность фермента, содержащегося в 1 г моркови.
79. Число нейтральных, основных и кислых аминокислотных остатков в составе лизоцима, рибонуклеазы и цитохрома с таково:
| Наименование фермента | Аминокислотные остатки | |||
| всего | нейтральные | основные | кислые | |
| Лизоцим из куриного яйца Рибонуклеаза из поджелудочной железы быка Цитохром с из плесневого гриба |
Рассчитайте процентное содержание неполярных, основных и кислых аминокислотных остатков от общего числа аминокислотных остатков в составе указанных белков и выведите закономерности состава перечисленных ферментов в этом отношении.
80. Рассчитайте удельную активность карбоангидразы (М =30 000), гексокиназы (М = 45 000) и альдолазы (М = 142 000), зная, что их молекулярная активность равна 0,96×108, 1,7×104 и 4,2×103 соответственно.
81. Определите, в каком состоянии находится HS-группа цистеина (рКа = 8,33) и имидазольный радикал гистидина (рКа=7,12) в молекуле гексокиназы в условиях оптимального рН (8,3—8,6) действия этого фермента.
82. Рассчитайте активность каталитических центров каталазы, лактатдегидрогеназы и алкогольдегидрогеназы (молекулярная активность их соответственно равна 5×106; 3,7×104 и 2,7×104), если известно, что число их у первый двух ферментов равно четырем, а у последнего - двум.
83. Определите удельную активность пируваткиназы (М =237 000), цитохрома с — редуктазы (М =75 000) и бутирил-КоА-дегидрогеназы (М =200 000), исходя из значения их молекулярной активности 6×103, 1,3×104 и 2×103 соответственно.
84. Активность аланин-аминотрансферазы определяют колориметрически по количеству динитрофенилгидразона пировиноградной кислоты, образующегося при реакции переаминироваиия α-кетоглутаровой кислоты и аланина. Рассчитайте активность аланин-аминотрансферазы в исходной вытяжке, если известно, что инкубацию проводили в течение 30 мин с 1 мл разведенной в 50 раз вытяжки фермента, причем получили количество динитрофенилгидразона, соответствующее 44 мг пировиноградной кислоты.
85. Рассчитайте молекулярную массу дигидрооротатдегидрогеназы, в состав которой входит 2 атома железа при содержании последнего 0,18%.
86. В состав сукцинатдегидрогеназы входят 8 атомов железа при содержании последнего 0,56%. Рассчитайте молекулярную массу фермента.
87. Рассчитайте среднюю длину (мм) двухцепочечных молекул ДНК, находящихся в одной клетке у различных представителей животного мира, если известно количество нуклеотидных пар (в млн.) в составе клеточной ДНК: а) млекопитающие - 5500; б) амфибии - 6500; в) рыбы - 2000; г) птицы - 2000; д) ракообразные - 2800; е) моллюски -1100; ж) губки - 100; з) грибы - 20; и) бактерии - 2.
88. Клетка печени крысы содержит 9,1×1012 гДНК. Допуская, что вся ДНК равномерно распределена между 42 хромосомами и существует в каждой хромосоме в виде единой молекулы, рассчитайте длину двухцепочечной ДНК (см), находящейся в одной хромосоме (число Авогадро равно 6×1023).
89. Молекулярная масса фрагмента ДНК равна 500 000. Рассчитайте объем фрагмента молекулы ДНК (нм3) при условии, что она имеет форму цилиндра.
90. В составе рибосомы кишечной палочки содержится по одной молекуле 23 S, 16 S и 5S РНК. Рассчитайте процентное соотношение трех видов РНК в рибосоме кишечной палочки.
91. Температура плавления ДНК линейно зависит от содержания ГЦ-пар в ее составе, и эта зависимость имеет вид: Тпл = 69,3 + 0,41А, где А - содержание ГЦ-пар (%). Рассчитайте температуру плавления образцов ДНК в стандартных солевых растворах, выделенных из различных бактерий, содержание ГЦ-пар в которых соответственно равно: а) 37,6; б) 47,6; в) 55,9; г) 61,0; д) 71,2.
92. Рассчитайте коэффициент молярной экстинкции аденина, если раствор, содержащий 500 мкг аденина в 100 мл 0,1 н. раствора гидроксида натрия, имеет оптическую плотность 0,458 при 262 нм (ширина кюветы равна 1 см). Молекулярная масса аденина 135.
93. Водный раствор, содержащий 57,8 мг/л натриевой соли УТФ, имеет оптическую плотность 1,014 при 262 нм (рН = 7,0). Вычислите коэффициент молярной экстинкции указанного вещества в этих условиях. Молекулярная масса натриевой соли УТФ равна 586.
94. Коэффициент молярной экстинкции аденина в 0,1 н. растворе соляной кислоты при 262,5 нм равен 13,4×10-3 л/моль×см. Вычислите величину оптической плотности раствора аденина, содержащего 5 мкг основания в 1 мл раствора. Молекулярная масса аденина равна 135.
95. Рассчитайте величину оптической плотности (ширина кюветы 1 см; рН =7,0) следующих растворов: а) 67,5×10-3 мМ раствора цитозина при 260 нм; б) 9,0×10-3 мМ раствора урацила при 260 нм, если коэффициенты молярной экстинкции для этих оснований при 260 нм (рН = 7,0) равны 5,55×103 и 8,2×103 л/моль×см соответственно.
96. Рассчитайте молярную концентрацию: а) раствора гуанина, если оптическая плотность его при 260 нм, рН = 7,0 равна 0,625; б) раствора тимина, если оптическая плотность его при 260 нм, рН = 7,0 равна 0,075. Ширина кюветы 1 см. Коэффициент молярной экстинкции гуанина равен 7,2×103 л/моль×см, тимина - 7,4×103 л/моль×см.
97. Образец РНК гидролизовали 0,5 н. раствором гидроксида калия. Полученный раствор рибонуклеотидов использовали для определения нуклеотидного состава исследуемой РНК методом колоночной хроматографии. Этим методом удалось разделить ЦМФ и УМФ, тогда как АМФ и ГМФ не разделились и были элюированы с колонки суммарно одним пиком. Оптическая плотность раствора, содержащего АМФ и ГМФ, равна 1,047 при 260 нм и 0,292 при 280 нм. Определите концентрации АМФ и ГМФ в растворе (необходимые данные см. в табл.).
| Нуклеотиды | Коэффициент молярной экстинкции (рН=7,0; ширина кюветы 1 см) при длине волны | |
| 260 нм | 280 нм | |
| АМФ ГМФ | 15,4×103 11,7×103 | 2,5×103 7,7×103 |
98. Длина молекулы ДНК кишечной палочки составляет 1100 мкм. Время генерации одного поколения кишечной палочки достигает 30 мин. Вычислите скорость редупликации ДНК в клетке кишечной палочки, выразив ее числом нуклеотидных пар, наращиваемых в течение минуты.
99. Фрагменты одной цепи ДНК имеют следующие последовательности нуклеотидов: а) ГЦААТГГГЦТАТ; б) АЦТАГТГЦЦА; в) ГЦТ5МЦАГГАТ. Какую нуклеотидную последовательность имеют комплементарные фрагменты второй цепочки той же молекулы ?
100. Определите нуклеотидную последовательность участков молекулы РНК, синтезированной с помощью РНК-полимеразы,если затравка имела следующие нуклеотидные фрагменты: а)АТЦГААЦТАЦГ; б) ЦТТАГГЦТАЦЦ; в) ТГАЦАГТААГЦГ.
101. В мРНК содержание аденина, цитозина, гуанина и урацила составляет 22, 27, 23 и 28% соответственно. Рассчитайте нуклеотидный состав участка двухцепочечной ДНК, на котором был осуществлен синтез указанной мРНК.
102. В клетках кишечной палочки (по данным С. Спигельмана и его сотрудников, использовавших метод гибридизации клеточной ДНК с рРНК) суммарная зона транскрипции 23 S рРНК (М = 1,1×106 дальтон) составляет 0,2% от клеточной ДНК, масса которой равна 3×109 дальтон. Второй тип рРНК (коэффициент седиментации 16 S, молекулярная масса 5,5×105) транскрибируется в зоне ДНК, не совпадающей с таковой для транскрипции 23 S рРНК, причем указанная зона занимает 0,1% от всей клеточной ДНК. Рассчитайте, синтез, какого числа молекул 16 S и 23 S рРНК потенциально возможен одновременно.
103. В бесклеточной системе с помощью полинуклеотидфосфорилазы из УДФ и АДФ, взятых в соотношении: а) 5:1 и б) 1:5, синтезированы полинуклеотиды. Рассчитайте в процентах содержание триплетов У3, У2А, УА2 и А3 в составе этих полинуклеотидов.
104. Фрагмент цепочки ДНК, имеющий последовательность нуклеотидов АГЦТАТ, был обработан азотистой кислотой. Какая нуклеотидная последовательность возникнет после двух циклов его репликации?
105. Фрагмент цепочки ДНК, имеющий последовательность нуклеотидов ЦГААТЦГТА, был обработан гидроксиламином. Какая нуклеотидная последовательность возникнет после двух циклов его репликации?
106. Подсчитайте количество молекул АТФ, которые сберегает клетка в результате биосинтеза ГТФ, если образование последнего происходит не заново, а из гуанина.
107. В культуре клеток человека (HeLa) цикл редупликации хромосом продолжается 6 ч. Средняя хромосома содержит ДНК с суммарной длиною около 3 см. Число хромосом у человека равно 46. Рассчитайте количество участков ДНК, реплицирующихся одновременно в хромосомном аппарате культуры тканей клеток человека, если средняя скорость редупликации составляет 30 мкм/мин.
108. Суточная потребность человека в L-триптофане составляет 0,25 г. Рассчитайте количество серотонина, образовавшегося из суточной дозы триптофана у здоровых и страдающих злокачественным новообразованием людей, если установлено, что в первом случае на это расходуется лишь 1 % триптофана, содержащегося в пище, а во втором — 60%.
109. Скорость включения аминокислот в альдолазу у животных в 1,8 раза выше, чем при включении в фосфорилазу. Определите, сколько радиоактивного аланина включается в тот и другой фермент через 12 ч после инъекции, если установлено, что в течение часа в альдолазу включается 12 мкг аланина.
110. В течение часа под действием оксидазы L-аминокислот из яда гремучей змеи 102 мг триптофана превратилось в соответствующую кетокислоту. Определите количество пировиноградной кислоты, высвобождающейся из аланина, инкубированного с ферментом в течение часа, если известно, что активность L-оксидазы яда гремучей змеи по отношению к аланину в 205 раз ниже, чем для триптофана.
111. На титрование в спиртовом растворе 10 мг неизвестной монокарбоновой кислоты было затрачено 3,5 мл 0,01 н. спиртового раствора гидроксида натрия. Рассчитайте молекулярную массу этой кислоты.
112. Рассчитайте йодное число масла, зная, что навеска масла составляла 0,375 г, а на титрование было израсходовано 5,8 мл 0,1 н. раствора гипосульфита в контроле и 3,8 мл - в опыте.
113. Рассчитайте кислотное число масла, если навеска его составляла 0,2521 а, а на титрование было затрачено 1,2 мл 0,1 н. раствора гидроксида калия.
114. Содержание железа в кристаллической каталазе равно 0,12%. Рассчитайте молекулярную массу протомера кристаллической каталазы, представляющего протеид с активной группой в виде железопорфиринового комплекса с одним атомом железа.
115. Рассчитайте процентное содержание меди в гемоцианине - медьсодержащем белке крови омара, если известно, что молекулярная масса его равна 780 000 и на одну молекулу приходится 20 атомов меди.
116. В процессе спиртового брожения на 1 моль распавшейся
глюкозы высвобождается 235 620 Дж, при гликолизе 1 моль глюкозы высвобождается 199 080 Дж. В каждом случае 53 800 Дж высвободившейся энергии запасается в макроэргических связях 2 моль АТФ. Рассчитайте коэффициенты полезного действия спиртового брожения и гликолиза.
117. Определите число молекул АТФ, синтезированных при полном окислении пяти молекул глюкозы по дихотомическому пути.
118. Напишите уравнение реакции окислительного декарбоксилирования изолимонной кислоты. Сколько молекул АТФ может синтезироваться при условии сопряжения этой реакции с фосфорилированием АДФ?
Варианты задач к контрольной работе №1
| Вари- ант | № задачи | Вари- ант | № задачи | Вари- ант | № задачи | ||||||
Контрольная работа №2
Специальность 2703 (260202) - «Технология хлебопекарного, макаронного и кондитерского производства»
Вариант 1
1. Пути превращений аминокислот при их диоссимиляции в организме. Напишите уравнения реакций дезаминирования и переаминирования аминокислот. Объясните участие ферментов и этих реакциях.
2. Ферментативный гидролиз жира. Дальнейшие химические превращения образовавшегося глицерина.
3. Характеристика α- и β-амилаз зерна, их действие на крахмал. Активация этих ферментов при прорастании зерна.
Вариант 2
1. Ферментативный гидролиз белка. Какие ферменты участвуют в этом процессе, какие образуются промежуточные и конечные продукты?
2. Химическое строение, биологическая роль и локализация в растительной клетке АТФ и АДФ.
3. Характеристика липидов зерна и муки и их изменения при хранении муки.
Вариант3
1. Ферментативный гидролиз крахмала. Характеристика амилолитического комплекса ферментов.
2. Биосинтез белков в живой клетке. Роль нуклеиновых кислот в этом процессе.
3. Назовите водорастворимые витамины зерна, напишите их химические структурные формулы, свойства, потребность в них.
Вариант 4
1. Ферментативный гидролиз и фосфоролиз крахмала. Какие промежуточные и конечные продукты образуются? Их характеристика.
2. Протеолитические ферменты: протеазы и протеиназы. Общая характеристика и участие в обмене белков.
3. Характеристика пектиновых веществ. Свойства, строение. Использование в кондитерском производстве.
Вариант 5
1. Химизм спиртового брожения. Напишите промежуточные стадии с указанием ферментов, катализирующих эти превращения.
2. Гидролиз жира липазой. Характеристика фермента. Дальнейшие химические превращения высших жирных кислот.
3. Характеристика протеолитических ферментов зерна.
Вариант 6
1. Современные представления о биологическом окислении, Участие дегидрогеназ в этом процессе.
2. Химическое строение витамина В1. Укажите гетероциклы, входящие вего состав. Напишите формулу кофермента тиаминпирофосфата и укажите, в состав какого фермента он входит.
3. Белковые вещества зерна.
Вариант 7
1. Химическое строение и биологическая роль цитохромов.
2. Механизм молочнокислого брожения. Напишите промежуточные стадии с указанием ферментов, катализирующих эти превращения.
3. Характеристика липидов зерна и их изменения при прорастании зерна.
Вариант 8
1. Однокомпонентные и двухкомпонентные ферменты. Строение коферментов. Приведите примеры.
2. Что такое дезаминирование аминокислот? Типы дезаминирования. Напишите уравнения реакций дезаминирования конкретных аминокислот.
3. Характеристика витаминов зерна. Охарактеризуйте каротин как провитамин витамина А.
Вариант 9
1. Аэробный обмен углеводов. Общее уравнение реакции, энергетика дыхания. Химизм окисления пирувата (ПВК) до ацетилкоэнзима А. Промежуточные этапы.
2. Характеристика ферментов класса гидролаз. Их участие в обмене углеводов.
3. Химический состав зерна, изменение при прорастании.
Вариант 10
1. Химическое строение коэнзима А и его участие в обмене высших жирных кислот.
2. Дегидрирование как основной путь биологического окисления. Участие ферментов дегидрогеназ и оксидаз в этом процессе. Напишите структурные формулы коферментов этих ферментов.
4. Химическое строение и биологическая роль токоферолов зерна.
Специальность 2704 (260203) - «Технология сахаристых веществ»
Вариант 1
1. Аэробный обмен углеводов. Общее уравнение реакций, образование пировиноградной кислоты и ее дальнейшие химические превращения в аэробных условиях.
2. β-окисление высших жирных кислот, образовавшихся в результате ферментативного гидролиза жира.
3. Химическое строение пектиновых веществ. Содержание их в корне сахарной свеклы. Что такое протопектин и пектин?
Вариант 2
1. Химизм спиртового брожения. Напишите все последовательно протекающие реакции и укажите участие в них ферментов.
2. Дезаминирование и переаминирование аминокислот. Укажите участие ферментов.
3. Химическое строение холина. Роль в производстве сахара.
Вариант 3
1. Химическое строение рибофлавина. Укажите особенности структуры, обусловливающие биологическую функцию витамина В2. Напишите формулы коферментов, содержащих рибофлавин, и укажите участие флавиновых ферментов в биологическом окислении.
2. Пути образования аммиака при промежуточном обмене аминокислот в растениях и его обезвреживание.
3. Ферментативные превращения ди- и трисахаридов, происходящие в свекловичном корне при его хранении.
Вариант 4
1. Какие биологические процессы в обмене углеводов приводят к превращению АДФ в АТФ? Напишите уравнения реакций.
2. Что такое ферменты? Отличия ферментов от небиологических катализаторов. Приведите примеры.
3. Изменения содержания Сахаров в свекловичном корне в процессе его хранения. Характеристика ферментов, участвующих, в этом процессе.
Вариант 5
1. Что такое переаминирование аминокислот? Напишите уравнения реакций с участием аминотрансферазы.
2.Химическое строение никотиновой кислоты, ее амиды. Напишите формулы коферментов, содержащих никотинамид. Биологическая роль ферментов, в состав которых входят эти коферменты.
3.Напишите реакции гидролиза и фосфоролиза мальтозы. К каким классам и подклассам относятся эти ферменты?
Вариант 6
1. Что такое дезаминирование? Напишите уравнения реакций различных видов дезаминирования аминокислот.
2. Химическое строение пигментов, растворимых в жирах: хлорофилле и каротине. Биологическая роль.
3.Сахара свекловичного корня. Их строение, свойства, ферментативные превращения.
Вариант 7
1. Фотосинтез. Общее уравнение реакций. Роль хлорофилла в процессе ассимиляции углекислого газа растением,
2. Химическое строение и биологическая роль триптофана: биосинтез витамина РР, его участие в построении коферментов анаэробных дегидрогеназ.
3. Гликозиды, находящиеся в клубнях картофеля. Характеристика соланинов.
Вариант 8
1. Роль нуклеиновых кислот в процессе биосинтеза белка.
2. Характеристика ферментов класса трансфераз. Участие фосфотрансфераз в процессе брожения. Напишите уравнения соответствующих реакций и назовите ферменты.
3. Пектиновые вещества. Их химическое строение, свойства. Содержание в корне сахарной свеклы.
Вариант 9
1. Обмен пировиноградной кислоты в аэробных условиях.
2. Ферментативный гидролиз фосфолипидов.
3.Синтез сахарозы в растениях.
Вариант 10
1. Строение крахмала. Амилоза и амилопектин, их гидролиз амилолитическими ферментами. Характеристика а-, β-форм и глюкоамилаз.
2. Какие соединения называются макроэргическими? Каковы их функции в организме? Назовите эти соединения и напишите их структурные формулы.
3. Пентозофосфатный путь окисления углеводов.
