Глава 12. химия радиоактивных элементов
Радиоактивными называются химические элементы, все изотопы которых радиоактивны, то есть совокупность радиоактивных атомов с одинаковым зарядом ядра. Известно, что в настоящее время можно получить радиоактивные изотопы практически всех элементов периодической системы, но такие элементы не принято называть радиоактивными. В основном радиоактивными элементами
В основном радиоактивными являются тяжелые элементы, расположенные в конце периодической системы после висмута. Среди элементов периодической системы - висмут последний практически не радиоактивный элемент. И он же открывает шеренгу тяжелых элементов - естественных альфа – излучателей. Тонкими экспериментами установлено, что стабильность висмута - кажущаяся. В действительности же ядра висмута иногда « гибнут». Период полураспада основного природного изотопа висмута 209Bi –более 2·1018 лет. Это примерно в полмиллиарда раз больше возраста нашей планеты. Принято считать висмут последним стабильным элементом периодической системы элементов Д.И. Менделеева., поскольку у него достигается предельное соотношение числа нейтронов и протонов (N/Z=126/83=1,518 , еще обеспечивающее стабильность ядра. У элементов с Z> 83 число нейтронов слишком велико и начинает сказываться нестабильность самого нейтрона. Лишь два элемента - технеций (№ 43) и прометий (№61)- не подчиняются этому правилу. Их нестабильность связана с другим обстоятельством. Отсутствие в природе технеция и прометия и всех элементов после урана связано с двумя причинами. Во - первых, их периоды полураспада меньше, чем возраст Земли. И, во-вторых, эти элементы не являются членами естественных радиоактивных рядов, поэтому их запас не возобновляется за счет радиоактивного равновесия. Кроме того, отсутствие стабильных изотопов этих двух элементов обусловлено квантово - механическими правилами отбора.
Химия радиоактивных элементов отличается от химии нерадиоактивных элементов теми особенностями,о которых упоминалось выше. В природных объектах и при искусственном получении радиоактивные элементы находятся в сверхнизких концентрациях, поэтому изучение их свойств осуществляется обычно с использованием специфических методов. Лишь уран и торий с первых лет их открытия изучались методами классической химии. В последние годы появилась возможность изучения таких радиоактивных элементов, как нептуний, плутоний, технеций, полоний и некоторых других в аналитических количествах.
Радиоактивные элементы делят на природные и искусственные. К природным относятся элементы с порядковыми номерами от 84 до 92: уран, торий и продукты их распада, полоний, астат, радон, франций, радий, актиний, и протактиний.
К искусственным радиоактивным элементам относят технеций, прометий, и так называемые, трансурановые элементы с порядковыми номерами от 93 до 110: нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний (№99), фермий, менделеевий (№ 101), нобелий (№ 102), лоуренсий (№ 103) , дубний (№ 104), жолиотий (№ 105), резерфордий (№ 106), борий (№ 107), ганий (№ 108), мейтнерий (№ 109), унуннилуй (№110) и т. д.
Элементы от актиния (№ 89) до лоуренсия (№ 103) составляют группу, которую называют актиноидами.
Деление радиоактивных элементов на естесственные и искусственные условно. Астат впервые был получен искусственно, позже его короткоживущие изотопы были обнаружены в семействах урана- 238, урана-235 и тория-232, Искусственный элемент плутоний в концентрациях 10-14г на 1 г урана находится в рудах урана. Радиоактивные изотопы всех естественных элементов получены искусственно.
По своей химической природе радиоактивные элементы не относятся ни к определенному периоду, ни к определенной группе элементов периодической системы. Среди них имеются sp – элементы (франций, радий, полоний, радон, астат), d – элементы (технеций, элементы с Z ≥ 104), а также f – элементы (прометий, элементы с Z = 89 ÷ 103).
Для понимания и изучения химии радиоактивных элементов чрезвычайно важное значение имеет знание свойств и поведения соответствующих стабильных аналогов.
Описание радиоактивных элементов обычно проводится по следующей схеме:
положение в периодической системе;
история открытия;
физические свойства;
химические свойства;
методы выделения;
методы определения;
применение.
В основе предлагаемой последовательности изложения свойств радиоактивных элементов лежит увеличение их порядкового номера.
12.1 Технеций (экамарганец) 43Tc
Д. И. Менделеев предсказал существование этого элемента. Ближайшие химические аналоги технеция – марганец и рений. В 1937 году Сегре и Перье и получил технеций по реакции 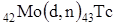 . Технеций обнаружен среди осколков деления урана. В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106 лет. Наиболее важными из них являются изотоп
. Технеций обнаружен среди осколков деления урана. В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106 лет. Наиболее важными из них являются изотоп 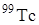 и его ядерный изомер
и его ядерный изомер 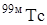 . Основным источником получения
. Основным источником получения 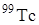 является деление урана или реакции :
является деление урана или реакции :
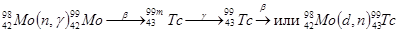
Элементарный технеций – металл серебристого цвета, относится к YII группе элементов периодической системы Менделеева. Технеций относится к подгруппе марганца Mn – Tc – Re. По химическим свойствам Тс ближе к рению, чем к марганцу. Наиболее устойчивой и характерной степенью окисления технеция является +7. При низких температурах он обладает сверхпроводимостью
Так как технеций содержится в продуктах деления урана и в молибденовых мишенях, важной задачей является отделение технеция от продуктов деления и от молибдена.
По степени эффективности методы выделения технеция можно расположить следующим образом: экстракционные > ионообменные > осадительные > дистилляционные > электрохимические. Например, для отделения технеция от продуктов деления могут быть использованы методы соосаждения с сульфидами тяжелых металлов и труднорастворимыми перхлоратами.
Применение технеция обусловлено как его уникальными свойствами, так и благоприятными ядерно-физическими характеристиками его основного изотопа 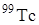 (большой период полураспада, мягкое в – излучение).
(большой период полураспада, мягкое в – излучение).
Обладая высокой коррозионной устойчивостью и малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении, сверхпроводимость технеция и его сплавов позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов. 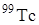 используется для приготовления в – источников,
используется для приготовления в – источников, 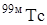 используется в медицине для диагностики болезней щитовидной железы и урологических заболеваний, для изготовления высокотемпературных термопар. Из продуктов деления
используется в медицине для диагностики болезней щитовидной железы и урологических заболеваний, для изготовления высокотемпературных термопар. Из продуктов деления 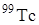 получают в килограммовых количествах, в то время как 1 килограмм урана в урановой руде дает содержит 5·10-10 г
получают в килограммовых количествах, в то время как 1 килограмм урана в урановой руде дает содержит 5·10-10 г 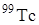 . Для получения
. Для получения 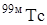 готовят изотопный генератор из
готовят изотопный генератор из 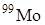 , который адсорбируют из азотнокислого раствора на колонке из Al2O3, Тс вымывают разбавленной азотной кислотой.
, который адсорбируют из азотнокислого раствора на колонке из Al2O3, Тс вымывают разбавленной азотной кислотой.
12.2 Прометий – 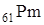
Прометий входит в цериевую группу лантанидов. В соответствии с правилами устойчивости ядер у элементов с порядковым номером 61 не может быть стабильных изотопов, элемент радиоактивен 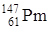 . Впервые прометий был выделен химически в 1947 году Маринским и Гленденином из продуктов деления урана
. Впервые прометий был выделен химически в 1947 году Маринским и Гленденином из продуктов деления урана 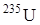 , Т1/2 = 2,6 года. В ядерном реакторе на 100 кВт мощности в сутки образуется 1 мг элемента 61. Из 1 кг Pu в реакторе получается около 7 г Pm.
, Т1/2 = 2,6 года. В ядерном реакторе на 100 кВт мощности в сутки образуется 1 мг элемента 61. Из 1 кг Pu в реакторе получается около 7 г Pm.
Название Pm получил по имени мифологического титана Прометея, похитившего огонь и передавшего его людям.
В настоящее время известно более 20 изотопов и ядерных изомеров прометия с массовыми числами, но наиболее доступным и имеющим практическое применение является 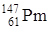 (Т1/2 = 2,64 года).
(Т1/2 = 2,64 года).
Прометий может быть также получен по реакции:
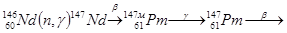 .
.
В соответствии с положением элемента в периодической системе единственной устойчивой степенью окисления Pm является +3. Ближайшие его химические аналоги – соседние с ним лантаноиды – неодим и самарий. Химические свойства лантанидов близки.
В крайне разбавленных растворах при рН < 3 Pm находится в ионном состоянии. При рН > 3 в результате гидролиза начинается образование радиоколлоидов. При рН 6-7 Pm сильно адсорбируется на стекле.
Из облученных материалов, продуктов деления урана и природных материалов прометий выделяется с фракцией редкоземельных элементов и иттрием, отделение от которых является основной задачей при получении и анализе прометия.
Важнейшими методами выделения прометия является ионообменная хроматография и экстракция. Для выделения прометия используются также процессы соосаждения, основанные на изоморфизме оксалатов и фторидов редкоземеньных элементов или на адсорбции прометия на оксидах и гидроксидах металлов.
Все области применения 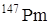 обусловлены его ядерно-физическими характеристиками (мягкое в – излучение, отсутствие г – фона, большой период полураспада).
обусловлены его ядерно-физическими характеристиками (мягкое в – излучение, отсутствие г – фона, большой период полураспада).
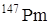 используется для изготовления изотопных источников тока (атомных электрических батарей), основанных на действии в– излучения на люминофоры, которые в свою очередь, действуют на фотоэлементы, превращающие световую энергию в электрическую. Такие источники используются в космических исследованиях,в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах и часах.
используется для изготовления изотопных источников тока (атомных электрических батарей), основанных на действии в– излучения на люминофоры, которые в свою очередь, действуют на фотоэлементы, превращающие световую энергию в электрическую. Такие источники используются в космических исследованиях,в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах и часах. 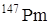 используется также для изготовления изотопных ионизаторов для снятия электростатических зарядов. Кроме того
используется также для изготовления изотопных ионизаторов для снятия электростатических зарядов. Кроме того 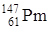 используется как источник в– излучения для измерения толщины и плотности материалов небольшой толщины.
используется как источник в– излучения для измерения толщины и плотности материалов небольшой толщины.
12.3 Полоний 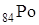
В 1898 году элемент с порядковым номером 84 был открыт П. и М. Кюри и назван в честь родины Марии – Полоний. Полоний в природе очень редок, он существует только как продукт радиоактивного распада в урановых и ториевых минералах, в которых образуется по реакціям 209 83Bi (n, g) 83Bi210 (b-распад, 2,6×106 лет)®84 210Po (a- распад,138 суток )
В равновесии с 1 г урана находится 7,6·10-11 г Ро, а с 1 г Ra – 2,24·10-4 г. Распространенность в земной коре равна 2·10-14 масс.%.
Известно 6 природных изотопов Ро и 20 радиоактивных искусственных изотопов и 2 изомера полония.
Наиболее долгоживущими изотопами полония являются 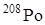 (2,93 года) и
(2,93 года) и 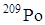 (Т1/2 = 103 года) и естественный радионуклид
(Т1/2 = 103 года) и естественный радионуклид 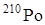 (Т1/2 = 138 дней). Химические и физические свойства полония исследованы с помощью химических микрометодов.
(Т1/2 = 138 дней). Химические и физические свойства полония исследованы с помощью химических микрометодов.
Ро – серебристо – белый металл с желтоватым оттенком, напоминающий таллий и висмут, в темноте светится.
Полоний – элементУI группы периодической системы. Он образует соединения со степенями окисления –2, +2, +4, +6, возможно +3. Наиболее устойчивой степенью окисления является +4. В электрохимическом ряду полоний занимает место между теллуром и серебром.
По химическим свойствам полоний сходен со своим аналогом по группе периодической системы теллуром, и отчасти – с висмутом.
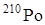 может быть получен искусственным путем по реакции:
может быть получен искусственным путем по реакции: 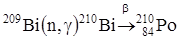 .
.
Полоний дает изоморфные кристаллы с теллуратами свинца и калия.
В водных растворах Ро является сильнейшим коллоидообразователем, в области рН ≥ 1 все соли и комплексные соединения полония гидролизованы и образуют как истинные растворы, так и псевдоколлоиды.
В области рН = 7,5 соли полония дают истинные коллоиды и хорошо адсорбируются на стекле, бумаге.
Для отделения полония из раствора применяют электрохимические методы, экстракцию, хроматографию и соосаждение. Простейший метод – использование реакции электрохимического замещения. Серебряная пластина в растворе RaD ( 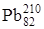 ) в 0,1 HCl, полученная толщиной 50 мк пластина растворяется в HNO3 и затем серебро осаждается HCl.
) в 0,1 HCl, полученная толщиной 50 мк пластина растворяется в HNO3 и затем серебро осаждается HCl.
Выделяется Ро также на пластине из смеси, 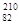 Pb и
Pb и 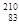 Bi.
Bi.
Благодаря большому тепловыделению полоний в основном используют в качестве источника тепловой энергии в космических аппаратах.
Кроме того, полоний находит применение в качестве наиболее доступного б – источника и для изготовления полоний – бериллиевых источников нейтронов. Для этих целей его получают искусственно путем нейтронного облучения 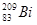 .
. 
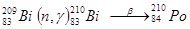 .
.
12.4 Астат 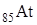
Астат (Менделеев в таблице оставил клетку для элемента с номером 85). В 1940 году Корсон, Маккензи и Сегре получили искусственный элемент облучением в циклотроне Вi б – частицами.
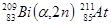 , Т1/2 = 7,2 часа
, Т1/2 = 7,2 часа
Астат – в переводе с греческого языка означает нестабильный. В настоящее время для стандартизации элемент называется астат.
Позднее было доказано, что астат образуется в семействах урана –235, 238, тория, но все они являясь в- излучателями имеют очень короткие периоды полураспада. В земной коре оценивается содержание At в 69 мг в слое 1,6 км.
В настоящее время известно 24 изотопа астата с массовыми числами от 196 до 219, наиболее долгоживущие 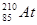 и
и 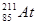 с периодами полураспада 8,3 и 7,2 часа соответственно.
с периодами полураспада 8,3 и 7,2 часа соответственно.
85-ый элемент является наиболее тяжелым элементом группы галогенов- не имеет нерадиоактивных изотопов, но помощью ядерных реакций
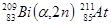 , Т1/2 = 7,2 часа или 209 83Bi (a,3n) 210 85At.
, Т1/2 = 7,2 часа или 209 83Bi (a,3n) 210 85At.
В настоящее время этот элемент можно получить в количестве, достаточном для изучения его химии микрометодами.
Астат как все тяжелые элементы обладает рядом металлических свойств.молекулярного астата напоминают свойства молекулярного йода, но как все тяжелые элементы обладает рядом металлических свойств.
Астат по аналогии с иодом возгоняется, на чем основано его отделение от мишени.
Степени окисления –1, +1, +5 и, вероятно, +7. Подобно Bi и Po At может образовывать радиоколлоиды и сорбироваться на стекле и других материалах.
В организме астат ведет себя как йод (накапливается в щитовидной железе), на этом основано его использование в качестве радиофармацевтического препарата.
Вследствие малого Т1/2 астат не может быть получен в весомых количествах. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
Химия астата изучалась только ультрамикрохимическими методами при концентрации 10-9 – 10-15 моль/л.
12.5 Радон ( 86Rn)
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-234 и урана-235 Оуэнсон, Резерфордом и Дорном установлено, что изотопы радия-226Ra , 224Ra ,223Ra в результате испускания a-частиц превращаются в изотопы элемента с порядковым номером 86-радон( 222Rn),торон ( 220Rn) , актинон(219Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222Rn с Т1/2=3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
Кроме естественных изотопов радона в настоящее время получено искусственно еще более 10 короткоживущих изотопов с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, пртекающие при облучении ториевых мишений протонами высоких энергий:
Определение молекулярной массы радона показало, что он является одноатомным газом. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения-61,8 0С, затвердевающую при -71 0С.Твердый радон светится ярко-голубым цветом.
Исследования химических свойств, проведенные Рамзаем, Резерфордом и Содди показали, что радон и его изотопы являются химическими аналогами инертных газов. Его электронная конфигурация 5s2 5p65d 10 6s2 6p6, т.е. его внешние электронные уровни полностью заполнены, что и определяет его инертность. В то же время, несмотря на то ,что радон принадлежит группе инертных газов, он образует вполне определенные группы соединений. Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон, подобно другим инертным газам, при действии сильных окислителей, например, жидкого фтора, фторидов, О2F2, при определенных условиях образует фториды-RnF2 , а также комплексные ионы типа RnF×MeF6, RnF2×2Sb F5 , , RnF2×2BiF5 и RnF2×IF5. Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре. Радон применяют для получения искусственных радоновых ванн при лечении ревматизма, радикулита и прочих заболеваний. Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему.
Определяется радон либо радиометрическим методом по радиоактивности продуктов его распада и сравнению их с эталоном, либо непосредственно по интенсивности собственного a-излучения.
12.6 Франций( 87Fr)
В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия. Лишь в 1939 г. Перей открыла элемент с порядковым номером 87, химически выделив его из продуктов распада актиния, и назвала в честь своей родины францием ( Fr):
227Ac®223Fr( Т1/2=21 мин.)
Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия.
В природе франций в ничтожных количествах содержится во всех урановых рудах( 1 атом Fr на 7,7×1014 атомов 235U или 3×1018 атомов природного урана).
В настоящее время известны изтопы франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235U и 232Th.
Получают 223Fr также путем облучения 226Ra нейтронами по схеме:
226Ra(n,g) 227Ra(n,g) 227Ac (a-распад) 223Fr
Это один из самых долгоживущих изотопов франция.
Франций не может быть получен в весомых количествах, поэтому все физические характеристики его найдены рассчетным путем.
Химические свойства франция изучены только с ультрамикроконцентрациями элемента радиохимическими методами с использованием цезия в качестве носителя.
В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал , чем цезий. Поэтому он может быть выделен только на ртутном катоде. Франций самый активный щелочной металл. Единственной степенью окисления франция является +1. Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике рака.
12.7 Радий (88Ra)
Радий был открыт М. и П.Кюри в 1898 г вслед за полонием. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3O8, полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. В двухлетних поисках этого вещества супруги Кюри провели химическое разложение большого количества урановой руды, химико-аналитическое разделение компонентов полученного раствора на фракции, содержащие известные химические элементы, и обнаружили, Было обнаружено, что фракции содержащии сульфид висмута и сульфат бария, обладают радиоактивностью. В дальнейшей работе с помощью дробной кристаллизации хлористого бария, полученного из сульфата бария, был выделен новый химический элемент с порядковым номером 88, названный Кюри радием (radius-луч). В настоящее время известно 13 изотопов радия, из них три являются членами естественных радиоактивных семейств. Наиболее долгоживущим из природных изотопов радия является изотоп 226Ra с периодом полураспада1622 года. 226Ra является a-g- излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг 226Ra. В верхнем слое Земной коры толщиной 1,6 км содержится 1,8×107т 226Ra.
Радий представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11группы периодической системы. Единственной степенью окисления радия является+2. Радий, белый блестящий металл с Ткип.=1140 и Тпл.=960.
По своим химическим свойствам радий похож на барий, но более химически активен. Радий энергично разлагает воду, давая гидроокись Ra(OH)2, более растворимую, чем Ва(ОН)2. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий склонен к комплексообразованию, так, например, он образует комплексы с лимонной ,молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2O3.
Радий сыграл большую роль в становлении радиохимии и ядерной физики как один из первых открытых радиоактивных элементов.
Основные области применения обусловлены его g-излучением в методах неразрушающего контроля для определения дефектов литья, в тощиномерах, при разведке месторождений урана. Альфа излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов.В смеси с бериллием радий используют для изготовления нейтронных источников. В медицине радий используют как источник радона. Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
12.8 Актиний ( 89Ас) и актиноиды
ОБЩИЕ СВОЙСТВА АКТИНОИДОВ
В 1898 году сотрудник Кюри Дебьерн в отходах от переработки урановых руд обнаружил новое радиоактивное вещество. При химико-аналитическом разделении это радиоактивное вещество осаждалось аммиаком вместе с редкоземельными элементами и торием. Радиоактивность была приписана радиоактивному элементу, который был назван актинием. Актиний- элемент главной подгруппы третьей группы периодической системы Д. И. Менделеева. Его ближайшим химическим аналогом является лантан. В то же время он имеет более основные свойства, чем лантан. Вопрос о положении в периодической системе элементов, расположенных за актинием, до сих пор остается дискуссионным. Наиболее широко распространенной является актиноидная гипотеза Г. Сиборга, предложенная в 1944 г.
Радиоактивные свойства некоторых изотопов актиния
| Изотоп актиния | Реакция получения | Тип распада | Период полураспада |
| 221Ac | 232Th(d,9n)225Pa(б)→221Ac | б | <1 сек. |
| 222Ac | 232Th(d,8n)226Pa(б)→222Ac | б | 4,2 сек. |
| 223Ac | 232Th(d,7n)227Pa(б)→223Ac | б | 2,2 мин. |
| 224Ac | 232Th(d,6n)228Pa(б)→224Ac | б | 2,9 час. |
| 225Ac | 232Th(n,г)233Th(в-)→233Pa(в-)→233U(б)→229Th(б)→225Ra(в-)225Ac | б | 10 сут. |
| 226Ac | 226Ra(d,2n)226Ac | б или в- или электронный захват | 29 час. |
| 227Ac | 235U(б)→231Th(в-)→231Pa(б)→227Ac | б или в- | 21,7 лет |
| 228Ac | 232Th(б)→228Ra(в-)→228Ac | в- | 6,13 час. |
| 229Ac | 228Ra(n,г)229Ra(в-)→229Ac | в- | 66 мин. |
| 230Ac | 232Th(d,б)230Ac | в- | 80 сек. |
| 231Ac | 232Th(г,p)231Ac | в- | 7,5 мин. |
| 232Ac | 232Th(n,p)232Ac | в- | 35 сек. |
СИБОРГ Глен
В соответствии с этой гипотезой элементы с порядковыми номерами 90-103 образуют 5f-cемейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы. Однако такое размещение трансактиноидной группы небезупречно. Актиноиды по своему химическому поведению занимают промежуточное положение между элементами f- и d- серий.
Актиний подобно лантану химически активный элемент, быстро окисляющийся на воздухе. В кислых растворах актиний присутствует в виде ионов. При рН>3 образуются коллоидные растворы. В микроконцентрациях актиний соосаждается гидроокисями иттрия, алюминия, железа. В урановых рудах актиний содежится в микроконцентрациях. Содержание актиниия в урановой руде составляет приблизительно 1/300 содержания радия.
Актиний может быть получен из урановых или ториевых руд отделением с лантаноидами, а также облучением радия нейтронами.
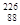 Ra( n,g)
Ra( n,g) 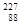 Ra
Ra 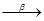
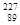 Ac .
Ac .
Актиний также подвергается бетта-превращению.
От ланатана актиний может быть отделен хроматографически на катионите в аммонийной форме. Хорошо актиний отделяется от лантана методом электрофореза. Из урановых руд актиний выделяется путем осуществления кислотного разложения руды и последующего разделения и выделения продуктов распада урана и отделения от примесей.
Вопрос о положении в периодической системе элементов, расположенных за актинием, до сих пор считается дискуссионным. К актиноидам относятся элементы с порядковыми номерами от 90 до 103, которые образуют 5f семейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы. По своему химическому поведению актиноиды занимают промежуточное положение между элементами f - и d- серий. Сюда входят- торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий. Теория подсказывает, что всего в слое 5 f может находиться 14 электронов. Следовательно,103-й элемент должен быть последним актиноидом, так как у него будут полностью застроены уровни 5f, 6s и 6p. С другой стороны, следует ожидать, что 104-й элемент будет находиться в состоянии 6d2 7s2,т.е. относится к четвертой группе системы Менделеева, следовательно, по свойствам он должен быть похож на торий.
Таблица. Наиболее важные изотопы актиноидов
| Изотоп | Период полураспада | Изотоп | Период полураспада |
| 227Ac | 22 года | 242Cm | 162,5 суток |
| 232Th | 1,39×1010 лет | 244Cm | 19 лет |
| 231 Pa | 34300 лет | 247Cm | ³4×107 лет |
| 238U | 4,5×109 лет | 248Cm | 4,7×105 лет |
| 237Np | 2,2×106 лет | 250Cm | 2×104 лет |
| 239Pu | 24360 лет | 247Bk | 1300 лет |
| 242Pu | 3,79×105 лет | 248Bk | 314 суток |
| 244Pu | 7,6×107 лет | 249Cf | 360 лет |
| 241Am | 458 лет | 251Cf | 660 лет |
| 243Am | 7600 лет | 254Es | 280 суток |
Торий (90Th)
Элемент № 90 был открыт обычным химическим методом в 1828 году Яном Берцелиусом и назван торием в честь древнескандинавского божества Тора. В 1898 году М. Кюри обнаружила, что торий обладает радиоактивностью. Именно радиоактивность- основная причина нынешнего интереса к элементу с порядковым номером 90.
Радиоактивность тория была обнаружена М. Кюри и одновременно с ней независимо немецким ученым Г. Шмидтом в 1898 году. Именно радиоактивность - основная причина нынешнего интереса к элементу № 90. Природный элемент практически представляет собой изотоп 232Th. Торий-232 является родоначальником довольно большого семейства. Период полураспада тория-232 равен 1,39·1010лет.
В периодической системе 232Th расположен в четвертой группе. Торий - металл серебристого цвета, легко подвергается механической обработке. Он очень легко окисляется, поэтому его хранят под слоем керосина. Торий способен проявлять степени окисления +4, +3, +2, наиболее устойчивой является +4. Только одно соединение тория - его двуокись ThО2 имеет самостоятельное применение, остальные же важны лишь для науки и… для производства тория.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ( трибутилфосфатом) после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория.
Торий - металл серебристого цвета, легко подвергается механической обработке. Он очень легко окисляется, поэтому его хранят под слоем керосина. Торий способен проявлять степени окисления +4, +3, +2, наиболее устойчивой является +4.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория. Методы соосаждения со специфическим (La, Ce) и неспецифическим Te(OH)3, BiPO4 носителями используются для получения препаратов  , применяемых в качестве радиоактивных индикаторов.
, применяемых в качестве радиоактивных индикаторов.
Применение тория. Элементом особой важности, стратегическим металлом торий стал лишь после второй мировой войны.
Как и всякий четно-четный изотоп (четное число протонов и нейтронов), торий-232 не способен делиться тепловыми нейтронами. Но под действием тех же нейтронов с торием происходит вот что:
Th232 + n -> Th233 -> Pa233 -> U233
А U233 - отличное ядерное горючее, поддерживающее цепное деление и имеющее некоторое преимущество: при делении его ядер выделяется больше нейтронов. Каждый нейтрон, поглощенный ядром плутония-239 или урана-235, дает 2.03-2.08 новых нейтронов, а уран-233 - намного больше - 2.37.
Применение тория в качестве ядерного горючего затруднено прежде всего тем, что в побочных реакциях образуются изотопы с высокой активностью. Главный из таких загрязнителей - уран-232 - альфа- и гамма-излучатель с периодом полураспада 73.6 года. Его использованию препятствует и то обстоятельство, что торий дороже урана. Уран легче выделить. Некоторые урановые минералы (уранит, урановая смолка) - это простые окислы урана. У тория таких. простых минералов (имеющих промышленное значение) нет. А попутное выделение из редкоземельных минералов осложнено сходством тория с элементами семейства лантана.
Главная проблема получения делящегося материала из тория состоит в том, что он изначально не присутствует в реальном реакторном топливе, в отличие от U-238. Для использования ториевого воспроизводства высокообогащенный делящийся материал (U-235, U-233, Pu-239) должен использоваться в качестве топлива реактора с включениями тория по большей части только для возможности воспроизводства (т.е. не происходит или происходит незначительное выделение энергии, хотя сгорание U-233, полученного на месте, может внести вклад в выделение энергии). С другой стороны, тепловые бридерные реакторы (на медленных нейтронов) способны использовать U-233/торий цикл воспроизводства, особенно если в качестве замедлителя использовать тяжелую воду.
Торий является перспективным материалом для ядерной энергетики. Делящимся элементом при этом служит  , образующийся по схеме:
, образующийся по схеме:
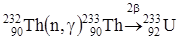 .
.
Достоинство тория как топливного материала определяется высокой температурой его плавления, отсутствием фазовых переходов, высокой механической прочностью и радиационной устойчивостью металлического тория и ряда его соединений. Использование тория в ядерной энергетике способно решить проблему истощения природных запасов урана. Из других областей применения тория представляет интерес использование его как катализатора, а также в качестве легирующих присадок к многокомпонентным сплавам, используемым в авиационной и ракетной технике.
Протактиний 91Pa
Протактиний по своим свойствам сходен с Nb, Ta, Zr, Hf, Ti. Это блестящий металл светло-серого цвета, покрытый на воздухе тонкой пленкой оксида. По твердости протактиний близок к урану. Интересным свойством протактиния является его сверхпроводимость при 2˚ К.
Металлический протактиний может быть получен термическим разложением его галогенидов на вольфрамовой нити при высокой температуре и давлении 10-3 – 10-4 Па. Протактиний легко реагирует с водородом. Степени окисления протактиния +5, +4,+3,+2, из которых наиболее устойчивой является +5.
Изучение химии протактиния осуществлялось методами классической химии с использованием долгоживущего изотопа  .
.
Основными методами выделения протактиния являются соосаждение, экстракция и хроматография. Наилучшими носителями являются фосфат циркония и гидроксид марганца (1У).
Применение протактиния.  применяется как источник получения
применяется как источник получения  по ядерной реакции:
по ядерной реакции:
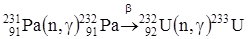 .
.
 - используется как изотопный источник тока,
- используется как изотопный источник тока,  используется в качестве ядерного топлива
используется в качестве ядерного топлива 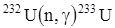 .
.
