Примеры решения типовых задач. Определить массу образующейся воды при сжигании 16 граммов водорода в избытке кислорода.
Пример 1
Определить массу образующейся воды при сжигании 16 граммов водорода в избытке кислорода.
Решение:
2Н2 + О2 = 2Н2О
В соответствии с коэффициентами в уравнении реакции мольное соотношение между водородом и водой равно 2:2=1:1. Количество вещества прореагировавшего водорода равно количеству вещества образовавшейся воды.
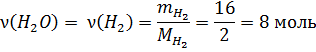

Ответ: 144 г.
Пример 2
Определить эквивалент и молярную массу эквивалента Fe2(SO4)3 в реакции
Fe2(SO4)3 + 6 NaOH = 2 Fe(OH)3 + 3 Na2SO4.
Решение:
Эквивалентное число z в ионообменной реакции равно знаменателю правильной дроби, полученной при делении коэффициента при данном веществе на максимальный коэффициент в уравнении реакции, при каком бы веществе он ни находился. Для Fe2(SO4)3 эквивалентное число равно 6. Эквивалент представляет собой условную частицу 1/6 Fe2(SO4)3
M(1/6 Fe2(SO4)3) = M(Fe2(SO4)3) / 6 = 400 / 6 = 66,7 (г/моль).
Ответ: 66,7 г/моль
Пример 3
Хлорид никеля массой 2,918 г взаимодействует с 1,8 г гидроксида натрия, молярная масса эквивалента которого равна 40 г/моль. Вычислить молярную массу эквивалента хлорида никеля.
Решение:
В соответствии со следствием из закона эквивалентов
m(хлорида) / m(NaOH) = M(1/z хлорида) / M(1/1 NaOH).
Отсюда
M(1/z хлорида) = 2,918 × 40 / 1,8 = 64,8 (г/моль)
Ответ: 64,8 г/моль
Пример 4
При сжигании 2,96 г металла было получено 4,91 г его оксида. Определить молярную массу эквивалента металла.
Решение:
Найдем массу кислорода, израсходованного при горении металла. В соответствии с законом сохранения массы веществ
m(O2) = m(оксида) – m(металла) = 4,91 – 2,96 = 1,95 (г).
При окислении металлов до оксидов газообразным кислородом происходит процесс: О20 + 4е- = 2О–2. Молекула кислорода принимает 4 электрона, следовательно, z = 4. На один электрон приходится 1/4 О2, поэтому эквивалент молекулярного кислорода 1/4 O2, а молярная масса эквивалента равна 8 г/моль.
По закону эквивалентов m(O2) / m(Me) = M(1/4 O2) / M(1/z Me);
Отсюда выразим M(1/z Me) и подставим численные значения величин:
M(1/z Me) = 2,96 × 8 / 1,95 = 12,1 (г/моль)
Ответ: 12,1 г/моль
Пример 5
Некоторый газ, имеющий плотность по воздуху, равную 0,965, был собран в сосуд емкостью 2 л методом вытеснения воды и находится в нем при температуре 25оС и давлении 99,8 кПа. Определите массу газа в сосуде, если давление паров воды составляет 3,17 кПа.
Решение:
Так как газ был собран в сосуд методом вытеснения воды, то он содержит пары воды. В соответствии с законом Дальтона для смеси не взаимодействующих газов, общее давление газовой смеси складывается из парциальных давлений отдельных ее компонентов. Найдем давление неизвестного газа.
Ргаза=Рсмеси–Рпара воды=99,8 кПа–3,17 кПа=96,63 кПа.
Зная относительную плотность газа по воздуху, рассчитаем его молярную массу в соответствии со следствием из закона Авогадро.
Мгаза=Dвозд.×Мвозд=0,965×29 г/моль » 28 г/моль.
Выразим массу газа m из уравнения Клапейрона-Менделеева и подставим в полученное выражение все величины в единицах системы СИ.
 ;
;

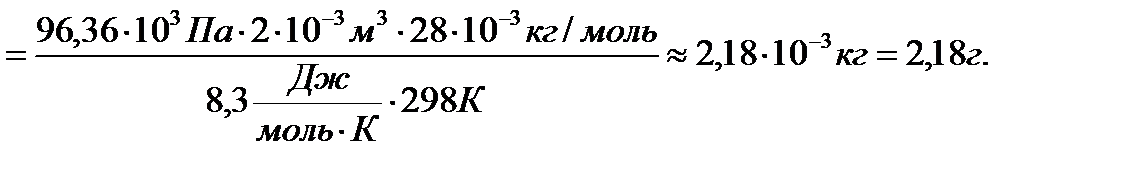
Итак, масса газа в сосуде равна 2,18 г.
Пример 6
В сосуде объемом 0,05 м3 при 25 0С содержится смесь из 0,020 м3 этилена под давлением 83950 Па и 0,015 м3 метана под давлением 95940 Па. Найдите общее давление газов в сосуде.
Решение:
Сначала определяем парциальное давление каждого из газов:


Общее давление газовой смеси равно сумме парциальных давлений ее компонентов: 
Пример 7
Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (Мвозд.=29 г/моль).
Решение:
DH2 = Mв-ва / MH2 = Мв-ва / 2;
Мв-ва= 2DH2 = 34 г/моль;
Dвозд = Mв-ва / Mвозд. = 34 / 29 = 1,17
Ответ: 1,17
Пример 8
Определите плотность по воздуху смеси азота, аргона и углекислого газа, если мольные доли компонентов составляли 15, 50 и 35% соответственно.
Решение:
Dсмеси(по воздуху) = Mсмеси / Mвозд. = Мсмеси / 29
Mсмеси = (15% ∙ 28 + 50% ∙ 40 + 35% ∙ 44) / 100% = (420 + 2000 + 1540) / 100 = 39,6 г/моль
Dсмеси(по воздуху) = Mсмеси / 29 = 39,6 / 29 = 1,37
Ответ: 1,37
Пример 9
Какой объем (н.у.) займут 0,4·10-3 м3 газа, находящиеся при 500С и давлении 0,954·105 Па? Определите количество вещества (в моль) этого газа.
Решение
Воспользуемся формулой объединенного газового закона
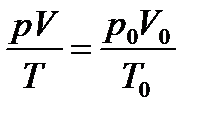
Объем газа при нормальных условиях (н.у.):
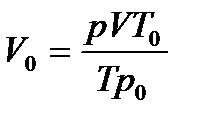 ,
,
где Т0=273 К;
P0=1,013·105 Па;
Т=273+50=323 К.

При нормальных условиях 1 моль любого газа занимает объем 22,4 л, поэтому

Перечень задач по теме 2
1. В 2,48 г оксида одновалентного металла содержит 1,84 г металла. Вычислите эквивалентные массы (молярные массы эквивалентов) металла и его оксида. Чему равна мольная и атомная масса этого металла.
2. 3,04 г некоторого металла вытесняют 0,252 г водорода, 26,965 г серебра и 15,885 г меди из соединений этих металлов. Вычислите эквивалентные массы (молярные массы эквивалентов) указанных металлов.
3. Оксид металла содержит 28,57% кислорода, а его фторид 48,72% фтора. Вычислите эквивалентные массы (молярные массы эквивалентов) металла и фтора.
4. Напишите уравнение реакций гидроксида железа (III) с соляной кислотой при которой образуются: а) хлорид дигидроксожелеза (III), б) хлорид гидроксожелеза (III), в) хлорид железа (III). Вычислите эквивалент и молярную массу эквивалента гидроксида железа в этих реакциях.
5. Избытком гидроксида калия подействовали на растворы дигидрофосфата калия и нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и молярные массы эквивалентов.
6. Вещество содержит 38% серы и мышьяк. Эквивалентная масса серы 16,0 г/моль. Вычислите молярную массу эквивалента и валентность мышьяка, составьте формулу данного сульфида.
7. Избытком соляной кислоты подействовали на растворы гидрокарбоната кальция и хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НCl, определите их эквиваленты и молярные массы эквивалентов.
8. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида.
9. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу металла.
10. На нейтрализацию 0,943 г фосфористой кислоты было израсходовано 1,291 г КОН. Вычислите основность кислоты и молярную массу эквивалента
11. Соединение металла с галогеном содержит 64,5% галогена, оксид того же металла содержит 15,4% кислорода. Определите галоген.
12. Вычислите молярную массу эквивалента оксида углерода (IV) в реакциях его образования при взаимодействии HCl с: а) КНСО3, б) К2СО3.
13. На нейтрализацию 2,3 г основания израсходовано 2,14 г НСl. Вычислить молярную массу эквивалента основания.
14. В каком количестве NаОН содержится столько же эквивалентов, сколько в 140 г КОН?
15. В каком количестве Ва(ОН)2∙8Н2О содержится столько же эквивалентов, сколько в 156 г Аl(OH)3?
16. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
17. Серная и ортофосфорная кислоты имеют одинаковую молярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
18. 1,6 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить молярную массу эквивалента цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль?
19. Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
20. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,4 г соли. Вычислить молярную массу эквивалента вещества и образовавшейся соли.
21. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2 . Найти молекулярную формулу газа.
22. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2%.
23. При пропускании над катализатором смеси, состоящей из 10 моль оксида серы (IV) и 15 моль кислорода, образовалось 8 моль оксида серы (VI). Сколько моль диоксида серы и кислорода не вступило в реакцию?
24. При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и водорода. Какой объем водяного газа (н.у.) может быть получен из 3 кг угля?
25. Через раствор, содержащий 7,4 г гидроксида кальция, пропустили 3,36л диоксида углерода (н.у.). Найти массу вещества, образовавшегося в результате реакции.
26. Рассчитать массу кристаллогидрата Cu(NO3)2∙3Н2О, полученного при растворении 10 г меди в азотной кислоте с последующим выпариванием раствора.
27. В одном из двух закрытых баллонов одинаковыми объемами находится кислород, в другом - азот. Массы обоих газов одинаковы. Температура обоих газов 27 0С. В каком баллоне давление больше и во сколько раз? До какой температуры следует нагреть содержимое одного баллона, чтобы давление внутри него достигло давления в другом баллоне?
28. В закрытом баллоне находится кислород массой 160 г под давлением 121,6 кПа при 120С. Вычислить массу диоксида углерода в таком же объеме, если он находится под давлением 202,6 кПа и при 370С.
29. Сколько литров кислорода при 210С и 104,5 кПа выделится при разложении 490 г КС1О3 ?
30. 1 г металла соединяется с массой хлора, занимающей 336 мл при 370С и 98 кПа. Вычислить молярную массу эквивалента металла.
