Вопрос. Перманганатометрия. Возможности метода
Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.

К достоинствам перманганатометрического метода относят:
1) возможность титрования раствором КМnО4 в любой среде (кислой, нейтральной, щелочной);
2) применимость растворов перманганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями; 3) стехиометричность и достаточно высокую скорость большинства окислительно-восстановительных реакций с участием МnО4- при оптимально выбранных условиях ;
4) возможность титрования без индикатора;
5) доступность перманганата калия.
Перманганатометрию используют в следующих целях :
1. Определение восстановителей
2. Определение окислителей.
3. Определение веществ, не обладающих окислительно-восстановительными свойствами (титрование по замещению). Например, ионы кальция, цинка, кадмия, кобальта осаждают в виде малорастворимых оксалатов.
4. Определение органических соединений (при обратном титровании).
44 вопрос. Реакции комплексообразования, используемые в аналитической химии. Количественные характеристики комплексных соединений: константы устойчивости и нестойкости.
Химические реакции, используемые в методах титриметрического анализа, в том числе в методах, основанных на комплексообразовании, должны удовлетворять определенным требованиям:
1) реакция должна быть стехиометричной;
2) реакция должна сопровождаться достаточно большим уменьшением энергии Гиббса и, следовательно, достаточно большой константой равновесия;
3) реакция должна протекать достаточно быстро. Кроме того, необходим удобный способ определения точки эквивалентности.
Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса Kнест. Чем меньше Кнест, тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе.
Константа равновесия реакции - константа устойчивости комплексного соединения:
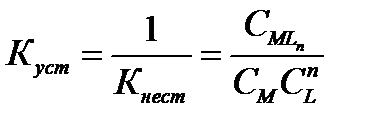
Лиганды:
-ОН – гидроксильная группа, -SH – сульфгидрильная (меркапто-) группа,
-СООН – карбоксильная группа
-NH2- аминогруппа, =N-OH – оксимная группа, О=С< – карбонильная группа.
