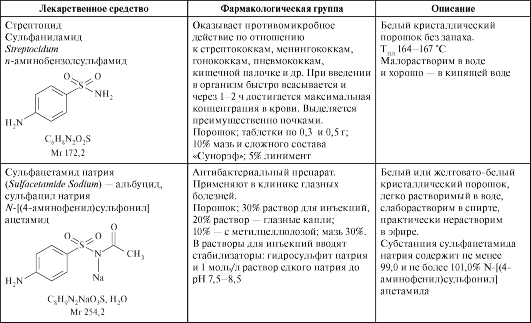
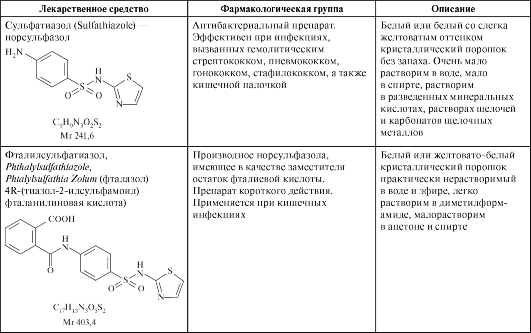
Лекарственные средства - производные сульфаниламидов
Окончание табл. 10.10
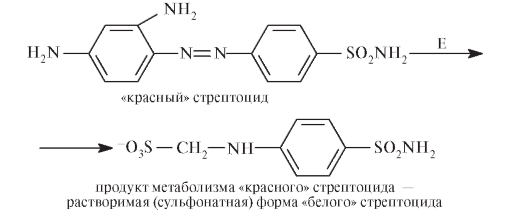
За открытие антибактериального эффекта пронтозила и его производных Г. Домагк был награжден Нобелевской премией в 1939 г. Оказалось, что антимикробным действием обладает не сам пронтозил, а продукт его метаболизма:
Всего в мире было синтезировано несколько сотен соединений указанной структуры, около 30 из них используют в медицине. Как выяснилось, замена NH2-группы в бензольном кольце на -CH3, -OH, -Cl, -COOH приводит к полной потере активности. Однако активность сохраняется в случае заместителей, содержащих замещенную аминогруппу: -CONH-, RN-, NH-, (CH3)2N-.
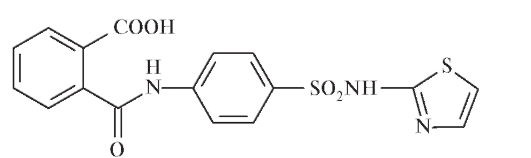
В молекуле бензолсульфонамида возможно одновременное замещение по амино- и сульфонамидной группе, например, в молекуле фталазола (фталилсульфатиазола):
Химические свойства замещенных по амидной группе сульфаниламидов можно проследить по схеме (рис. 10.2).
Таким образом, сульфонамиды проявляют амфотерные свойства. Ароматическая аминогруппа (основный центр) легко протонируется:
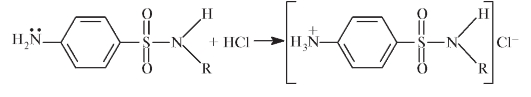
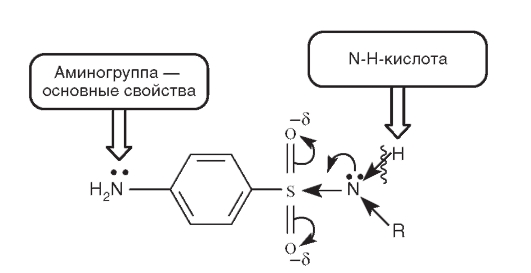
Рис. 10.2. Кислотный и основный центры в молекуле сульфонамидов
Основность ароматических аминов существенно ниже, чем аминов алифатического ряда, из-за _р,л-сопряжения и присутствия электроноакцепторных заместителей.
Одновременно эти соединения - слабые NH-кислоты. Кислотные свойства усиливаются за счет _р,л-сопряжения в сульфонамидном фрагменте:
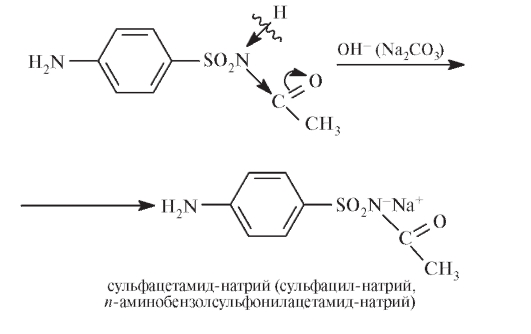
Кислотные свойства изменяются в зависимости от природы заместителя R. Например, при ацилировании происходит увеличение кислотности:
Получение
Исходным продуктом синтеза сульфаниламидов является анилин. На первой стадии проводят защиту аминогруппы в анилине, используя в качестве реагентов хлорангидрид угольной кислоты в метаноле (метиловый эфир хлорметановой кислоты).
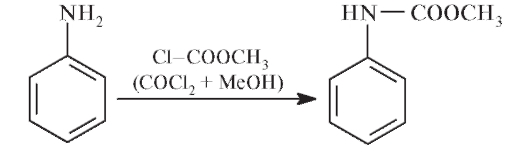
Образующийся карбамат при взаимодействии с хлорсульфоновой кислотой дает замещенный сульфанилхлорид:
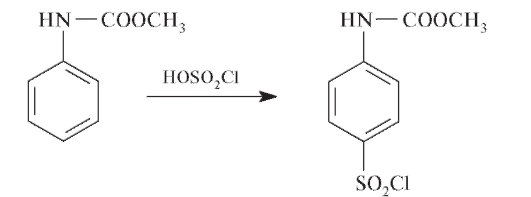
При обработке сульфанилхлорида аммиаком образуется сульфаниламид:
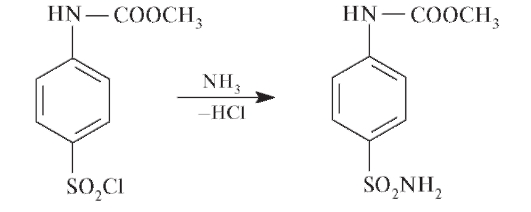
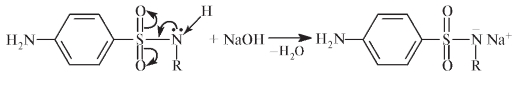
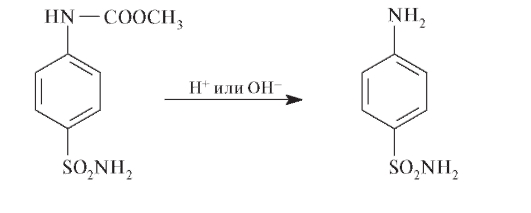
Регенерацию свободной аминогруппы проводят в кислой или щелочной среде:
Механизмы действия и биотрансформация
Сульфаниламиды являются антиметаболитами я-аминобензойной кислоты (см. главу 1).
Конкурентный антагонизм с я-аминобензойной кислотой приводит к нарушению синтеза тетрагидрофолиевой кислоты, необходимой для синтеза пуринов и пиримидинов. Именно блокированием синтеза фактора роста бактерий обусловлен бактериостатический эффект сульфаниламидных препаратов.
Контроль качества
Фармакопейный анализ сульфаниламидов рассмотрим на примерах сульфацетамида натрия (альбуцида) и фталилсульфатиазола (фталазола).
Определение подлинности
Первоочередными испытаниями обеих субстанций при определении подлинности является ИК-спектрометрия. ИК-спектры субстанций сравнивают со спектрами стандартных образцов сравнения сульфацетамида натрия и фталилсульфатиазола.
В водном растворе субстанции сульфацетамида натрия проводят реакцию на ион натрия.
Одним из испытаний подлинности фталилсульфатиазола является определение температуры плавления кристаллов, образующихся после высокотемпературного щелочного гидролиза, отделения фильтрованием продукта гидролиза - фталевой кислоты, малорастворимой в кислой среде, и образования осадка сульфатиазола (норсульфазола) при последующем подщелачивании раствора.
Методика: к 1 г субстанции добавляют 8,5 мл разбавленного раствора натрия гидроксида, кипятят смесь с обратным холодильником в течение 30 мин. Раствор охлаждают и добавляют 17,5 мл разбавленной HCl. Смесь интенсивно встряхивают и фильтруют. Фильтрат нейтрализуют разбавленным раствором натрия гидроксида. Фильтруют, осадок промывают водой, перекристаллизовывают из воды и сушат кристаллы при 100-105 °С. Кристаллы плавятся в интервале температур 200-203 °С. Схема опыта представлена на рис. 10.3.
При растворении около 10 мг полученных кристаллов в 200 мл 0,2 моль/л HCl образуется раствор, который дает реакцию на первичную ароматическую группу.
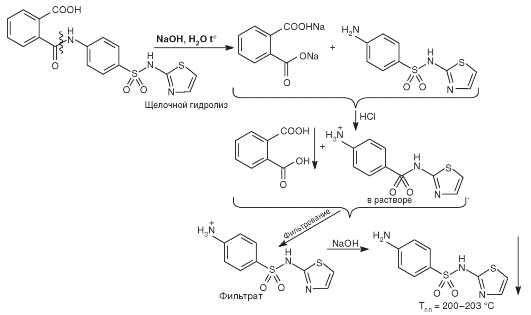
Рис. 10.3. Образование кристаллов сульфатиазола
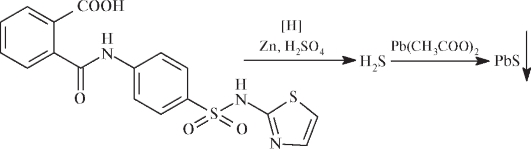
Дополнительные испытания фталилсульфатиазола - восстановление атомов серы до сероводорода, который образует темное пятно сульфида свинца на бумаге, пропитанной раствором ацетата свинца:
При взаимодействии фталилсульфатиазола с резорцином в присутствии серной кислоты при нагревании на водяной бане и при последующем охлаждении и подщелачивании раствора появляется интенсивная зеленая флуоресценция.
Методика проведения опыта: при смешивании 0,1 г фталилсульфатиазола и 0,5 г резорцина в присутствии серной кислоты при нагревании на водяной бане образуется гомогенная смесь. Смесь охлаждают и добавляют 5 мл разбавленного раствора натрия гидроксида. К 25 мл воды добавляют 0,1 мл образующейся краснокоричневой смеси. Появляется интенсивная зеленая флуоресценция, которая исчезает при подкислении.
Дополнительные испытания подлинности сульфацетамида натрия включают исследование раствора субстанции методом УФ-спектрофотометрии. Для этого растворяют 0,1 г субстанции в растворе фосфатного буфера с рН 7,0 и доводят раствор до 100 мл тем же раствором. Раствор разбавляют в 100 раз фосфатным буфером. УФ-спектр снимают в интервале от 230 до 350 нм. Наблюдается максимум при 255 нм. Удельный коэффициент погашения при максимуме поглощения составляет от 660 до 720 (расчет проводят для безводной субстанции).
Внутриаптечный контроль подлинности препарата может проводиться также в соответствии с фармакопейной статьей ЕФ. Для этого 1 г сульфацетамида натрия растворяют в 10 мл воды, добавляют 6 мл разбавленной уксусной кислоты. При этом более сильная кислота - уксусная - вытесняет из соли слабую кислоту - сульфацетамид, который выпадает в виде белого осадка:
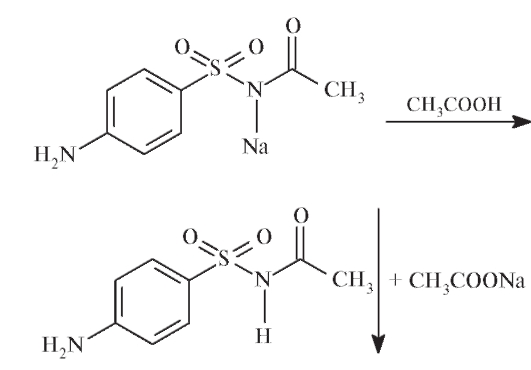
Осадок сульфацетамида отфильтровывают, промывают небольшим количеством воды и высушивают при 100-105 °С в течение 4 ч. Сульфацетамид плавится в интервале 181-185 °С.
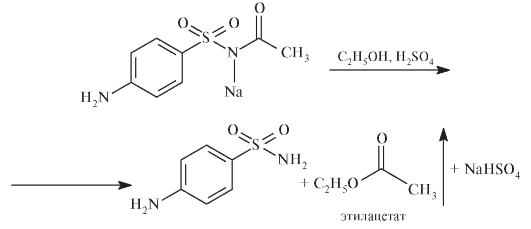
При добавлении к этанольному раствору сульфацетамида (0,1 г образовавшегося осадка в 5 мл этанола) 0,2 мл серной кислоты и осторожном нагревании появляется запах этилацетата:
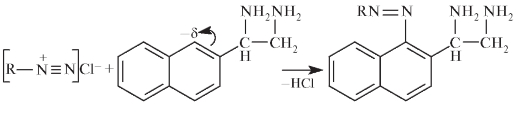
Присутствие свободной аминогруппы в молекуле сульфацетамида позволяет проводить его идентификацию по реакции на первичные ароматические амины. Реакцию проводят для раствора ЛС (1 мг осадка в 1 мл воды) с нитритом натрия в солянокислой среде. После добавления к образующемуся диазосоединению щелочного раствора р-нафтола появляется красно-оранжевое окрашивание азокрасителя:
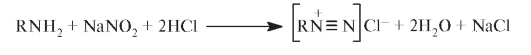
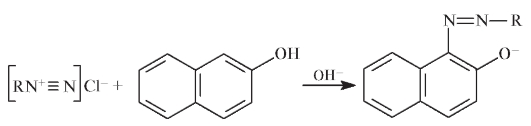
Испытания на чистоту
При определении примесей в субстанции сульфацетамида натрия готовят раствор 1,25 г субстанции в 25 мл воды. Значение pH этого раствора от 8,0 до 9,5.
Принимая во внимание кислотные свойства фталилсульфатиазола, раствор субстанции (20 мл) для испытаний на чистоту готовят, растворяя 1,0 г субстанции в 1 моль/л растворе натрия гидроксида. Растворы обеих субстанций должны быть прозрачными и иметь окраску, не превышающую по интенсивности окраску эталонных растворов.
Кислотность субстанции фталилсульфатиазола оценивают индикаторным методом. Для этого водную суспензию (2,0 г субстанции в 20 мл воды) встряхивают в течение 30 мин, после чего фильтруют. К 10,0 мл фильтрата добавляют 0,1 мл раствора фенолфталеина. Для изменения окраски индикатора из бесцветной в малиновую не должно уходить более 0,2 мл 0,1 моль/л раствора натрия гидроксида, что соответствует 0,02 ммоль Н+ в 1,0 г субстанции.
Родственные примеси в субстанции сульфацетамида натрия исследуют методом ТСХ на пластинах с силикагелем. Исследуемую субстанцию (1,5 г) растворяют в 15 мл воды (10%). Растворы сравнения (a, b) готовят, растворяя 5 мг стандартного образца сульфаниламида в 1 мл раствора (0,5%), - а, и двукратным его разведением - b. Третий раствор - с - готовят, растворяя 5 мг стандартного образца сульфаниламида в исследуемом растворе.
На хроматографическую пластину наносят по 5 мкл каждого раствора. В качестве подвижной фазы используют смесь: концентрированный аммиак/этанол/вода/бутанол (10:25:25:50). Пластину высушивают на воздухе и опрыскивают раствором диметиламинобензальдегида. Интенсивности всех образовавшихся пятен исследуемого раствора, не совпадающих с основным пятном, не должны превышать интенсивность окраски раствора сравнения (а) (0,5%) и раствора (b) (0,25%). Валидность теста несомненна только в случае четкого разделения пятен для раствора (с).
Примеси сульфатиазола и других первичных ароматических аминов в субстанции фталилсульфатиазола определяют следующим методом. 5 мг субстанции растворяют в предварительно охлажденной до 15 °С смеси из 3,5 мл воды, 6 мл разбавленной HCl и 25 мл этанола. Колбу помещают в ледяную воду и добавляют 1 мл раствора натрия нитрита с концентрацией 2,5 г/л. Через 3 мин добавляют 2,5 мл раствора сульфаминовой кислоты с концентрацией 40 г/л и оставляют на 5 мин. После добавления 1 мл раствора нафтилэтилендиамина дигидрохлорида (4 г/л) доводят объем до 50 мл водой. Измеренная при 550 нм абсорбция не должна превышать абсорбцию стандартного раствора, приготовленного тем же способом с использованием сульфатиазола (10 мг сульфатиазола, 0,5 мл раствора HCl, 2,5 мл воды, 6 мл разбавленной хлороводородной кислоты и 25 мл спирта).
Из методики ясно, что в основе определения примесей лежит реакция образования азокрасителя. Сначала из натрия нитрита в кислой среде образуется азотистая кислота, которая с примесями аминов дает и диазореактив:
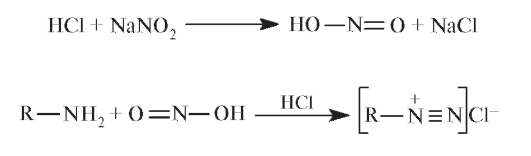
При добавлении сульфаминовой кислоты NH2SO2OH - моноамида серной кислоты легко удаляется избыток HNO2:
NH2SO2OH + HNO2 = H2O + N2+ H2SO4
В противном случае возможен расход основного реактива - нафтилдиаминоэтана при его нитрозировании:
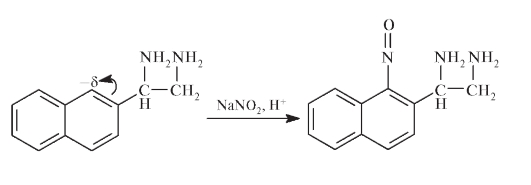
Конечная стадия испытания на примеси аминосоединений - исследование интенсивности поглощения света образующимся азокрасителем:
азокраситель
Допустимыми примесями в субстанции сульфацетамида натрия являются сульфаты. Для определения их содержания к раствору субстанции (2,5 г в 25 мл дистиллированной воды) добавляют 25 мл разбавленной уксусной кислоты, встряхивают в течение 30 мин и отфильтровывают. Предельному содержанию сульфатов (200 мкг/г) должны соответствовать 15 мл фильтрата.
Для определения содержания тяжелых металлов 12 мл раствора, полученного при испытаниях на сульфаты, должны соответствовать предельному содержанию тяжелых металлов (20 мкг/г). Эталонный раствор готовят из растворимой соли свинца с содержанием 1 мкг/г Pb.
Потеря в массе при высушивании субстанции фталилсульфатиазола - не более 2% в расчете на 1 г.
Содержание воды должно находиться в интервале 6,0-8,0% в расчете на 0,200 г субстанции при определении полумикрометодом.
