Диаграммы состояния сплавов и правило фаз гибса
При изменении концентрации компонентов, а также в процессе охлаждения или нагрева в сплавах происходят фазовые и структурные изменения, которые можно наглядно проследить с помощью диаграмм состояния, представляющих собой графическое изображение состояния сплавов.
Из вида диаграмм состояния определяют температуры плавления и полиморфных превращений в сплавах, число, а также качественный и количественный состав фаз.
Диаграммы состояния обычно строят экспериментально. Для их построения используют термический метод, с помощью которого получают кривые охлаждения сплавов. Обыгрывается то обстоятельство, что все изменения в агрегатном или фазовом состоянии сплава сопровождаются выделением скрытой теплоты превращения. По остановкам и перегибам на этих кривых, обусловленным тепловыми эффектами превращений, определяют температуры самих превращений. Точки перегиба или остановки на кривых охлаждения называются критическими точками. Они соответствуют температурам, при которых в сплавах начинаются или заканчиваются какие-либо превращения.
Эксперименты проводятся следующим образом. В печь помещают тигель из тугоплавкого материала (фарфора или кварца), в котором расплавляют исследуемый сплав. Затем в расплав помещают спай термопары (защищенный колпачком) и выключают печь. В процессе охлаждения до комнатной температуры температура сплава фиксируется в автоматическом режиме непрерывно. Анализируется вид кривой "температура - время", которая называется термограммой, с установлением температур всех остановок и точек перегиба, соответствующих тому или иному превращению. Проводя эксперименты на сплавах с различным соотношением компонентов с фиксацией для каждого сплава температуры превращений строится диаграмма состояния системы сплавов из данных компонентов.
По вертикали (ось ординат) диаграммы состояния откладывается температура, а по горизонтали (ось абсцисс) - концентрация компонентов. Каждая точка на оси абсцисс соответствует определенному содержанию одного и другого компонента с учетом того, что общее содержание компонентов в каждой точке этой оси соответствует 100%.
В качестве примера построения рассмотрим диаграмму состояния сплавов системы свинец - сурьма, как сплавов, компоненты которых неограниченно растворимы в жидком состоянии и взаимно нерастворимы в твердом состоянии, что обуславливает при охлаждении сплава образование механической смеси.
Кривые охлаждения для чистых свинца и сурьмы имеют по одному горизонтальному участку, отвечающему протеканию процесса кристаллизации при температуре 3270С для свинца и 6310С для сурьмы. На диаграмме состояния эти температуры соответствуют началу и концу оси абсцисс, где содержаться соответственно чистый свинец и чистая сурьма (рис. 3.4). Структура чистых металлов представляет собой однородные зерна.
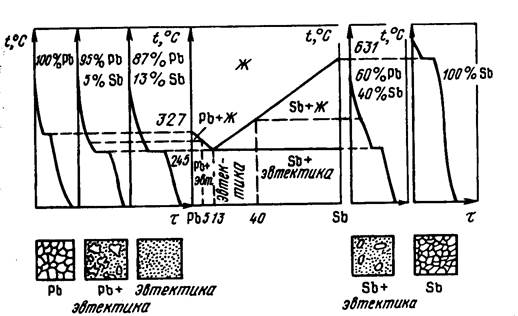
Рис. 3.4 Диаграмма состояния, кривые охлаждения и схемы структур сплавов системы Pb - Sb при полном охлаждении до комнатной температуры
Для систем, представляющих собой механические смеси, что имеет место в настоящем случае, добавка одного компонента к другому понижает температуру начала кристаллизации. Точка, соответствующая началу появления твердой фазы из расплава, имеет вид перегиба (излома) на температурной кривой (рис.3.4) и изменяется в зависимости от состава сплава. Температура же конца кристаллизации не зависит от состава сплава и одинакова для всех сплавов данной системы, т. е. данной пары компонентов.
Сплав, содержащий 13% сурьмы (Sb) и 87% свинца (Pb), характеризуется тем, что в нем происходит одновременная кристаллизация из жидкой фазы кристаллов Sb и Pb (в общем случае компонентов А и В) с образованием механической смеси. Такая механическая смесь из двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой (eutektos греч. - легко плавящийся). Сам сплав с 13%Sb и 87%Pb является эвтектическим, а его микроструктура представляет собой попеременно чередующиеся выделения сурьмы в свинцовой основе (рис. 3.4).
Принято эвтектическую реакцию записывать как Ж → Pb + Sb или в общем виде Ж → А + В.
Оценим возможность изменения температуры, при которой протекает данный эвтектический процесс. Для этого воспользуемся правилом фаз Гибса, устанавливающим соотношение между числом фаз, компонентов и степеней свободы в системе для условий равновесия:
Ф = К + 1 - С,
где Ф - число фаз, которое может существовать в системе при данных условиях (напомним, что фаза это однородная часть сплава, характеризующаяся определенным составом, свойствами, типом кристаллической решетки и отделенная от других частей сплава поверхностью раздела).
К - число компонентов в сплаве - число элементов или химических соединений, образующих сплав;
С - число степеней свободы - число независимых факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии. В данном случае число независимых факторов 2 - состав и температура.
В соответствии с правилом фаз в данной двухкомпонентной системе (К = 2) при наличии трех фаз (жидкость, кристаллы сурьмы и кристаллы свинца) число степеней свободы равно нулю (С = К - Ф + 1 = 2 - 3 + 1 = 0 система нонвариантна), что свидетельствует о том, что одновременная кристаллизация сурьмы и свинца должна протекать при постоянной температуре. По этой причине на термограммах охлаждения сплава, соответствующего эвтектическому составу, имеется один горизонтальный участок, т. е. одна критическая точка (2450С), характеризующая температуру затвердевания эвтектического сплава.
Сплавы, имеющие 0% < Sb < 13%, затвердевают в интервале температур и на кривых охлаждения имеются две критические точки, соответствующие началу и концу затвердевания. Кристаллизация любого из этих сплавов начинается с выделения кристаллов Pb с обогащением жидкости сурьмой. При числе компонентов К= 2, числе фаз Ф = 2 число степеней свободы С = 2 - 2 + 1 = 1, что свидетельствует о том, что каждому составу соответствует свое значение начала кристаллизации. При достижении концентрации сурьмы в расплаве 13% начинается одновременная кристаллизация из жидкости свинца и сурьмы. Точка, соответствующая полному затвердеванию сплава, не зависит от состава сплава (К = 2, Ф = 3, С = 0) и на термограмме имеет вид плато. Все эти сплавы называются доэвтектическими. Они претерпевают эвтектическое превращение при охлаждении ниже температуры 2450С и имеют после окончательного охлаждения структуру Pb + Э (Pb + Sb). В этой структуре имеется две структурные составляющие: кристаллы Pb и эвтектика Э (Pb + Sb), хотя в сплаве всего 2 фазы: Pb и Sb (подчеркнем, что эвтектическая смесь не является самостоятельной фазой).
Кристаллизация любого сплава с концентрацией 100% > Sb > 13% начинается с выделения кристаллов сурьмы. Эти сплавы называются заэвтектическими и имеют после охлаждения структуру Sb + Э (Pb + Sb). Структура заэвтектических сплавов также является двухфазной (кристаллы Sb и Pb) и состоит из двух структурных составляющих: кристаллов Sb и эвтектики Э (Pb + Sb).
Таким образом на диаграмме можно выделить три характерные зоны:
- область, где существует только жидкая фаза - выше системы линий, ограниченной точками 3270С, 2450С и 6310С;
- область, где существует только твердая фаза (кристаллы Pb и Sb) - ниже эвтектической линии (вся горизонтальная линия на уровне температуры 2450С);
- область, где одновременно существует жидкая и твердая фазы - между линиями, ограничивающими жидкое и твердое состояние сплавов.
Линия, ограничивающая на диаграмме область жидкой фазы сплавов, называется линией ликвидус. Линия, ограничивающая область полностью затвердевшего сплава, называется линией солидус.
