Методы построения диаграмм. Треугольник Таммана
Цели и задачи
Целью данной работы является практический анализ кривых охлаждения бинарных систем и построения на его основе диаграмм равновесия.
К основным задачам отчета относятся:
1. Определения методов построения диаграмм.
2. Объяснения принципа построения треугольников Таммана.
3. Изучения нонвариантного состояния.
4. Построение диаграмм состояния.
5. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы при охлаждении.
Раздел 1. Теоретическая часть
Методы построения диаграмм. Треугольник Таммана
Построение равновесных диаграмм основано на изучении количества и состава фаз при различных температурах. Для таких целей используют два метода:
1. динамический (метод кривых охлаждений);
2. статический (метод закалки).
Суть динамического метода заключается в построении кривых охлаждения (нагревания) для исходных составов системы в координатах ²температура – время² при постоянной скорости изменения температуры. При этом с помощью специального оборудования обнаруживаются тепловые эффекты, вызываемые физико-химическими процессы, происходящими в системе:
¾ полиморфные превращения;
¾ химические реакции;
¾ кристаллизация и плавление;
¾ разложение соединений системы.
При постоянной скорости охлаждения, длина горизонтальной площадки на кривой охлаждения зависит от количества фазы на момент начала процесса, определяющего этот процесс. То есть, если площадка на кривой охлаждения является следствием кристаллизации расплава эвтектического состава, то для исходного состава, совпадающего с эвтектическим, протяженность горизонтальной площадки будет максимальной. На этом правиле основан геометрический метод поиска точного местоположения некоторых элементов диаграмм, так называемый метод треугольника Таммана. На рис. 1 показаны примеры построения треугольников для перечисленных выше ситуаций.
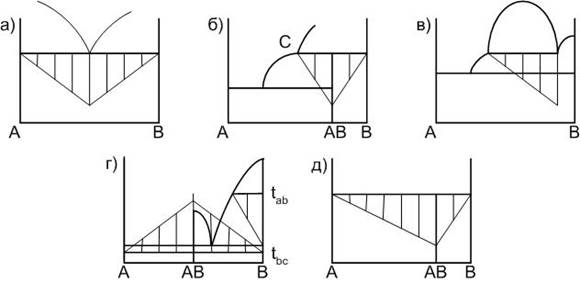
Рисунок 1. Элементы построения диаграмм двухкомпонентных систем:а – кристаллизация расплава эвтектического состава; б – образование химического соединения, плавящегося инконгруентно; в – ликвация; г – полиморфные превращения кристаллических фаз; д – образование химического соединения, разлагающегося в твердой фазе.
Для силикатных систем, в которых скорость установления равновесного состояния невелика, динамический метод дает не всегда корректный результат. В этом случае пользуются статическим методом, для этого:
1. Гомогенизированную смесь компонентов нагревают до заданной температуры.
2. Выдерживают длительное время при этой температуре.
3. Резко охлаждают.
4. Затем методами химического анализа проводят определение состава и количества образовавшихся фаз.
Эта процедура для одного состава многократно повторяется при изменении температуры выдержки и по полученным результатам строят диаграмму равновесия. Метод отличается высокой точностью, но большей, чем в динамическом методе, трудоемкостью.
Элементы диаграммы
Диаграмма состоит из вертикальной оси – ось температуры, горизонтальной оси – ось концентрации компонентов.
Внешний вид диаграммы приведен на рисунке 2. Левый конец горизонтальной оси концентраций компонентов, обозначенный буквой А, соответствует 100% содержанию компонента А, правый – 100% содержанию компонента В.
Та и Тв – соответственно температуры плавления чистых компонентов А и В. Если точка состава находится на одной из вертикальных осей диаграммы (на А или В), то в этом случае мы рассматривает процессы, происходящие в однокомпонентной системе.
Кривые Та – Е и Е – Тв носят название кривых ликвидуса. Кривые ликвидуса представляют собой температурные зависимости перенасыщения расплава по отношению к какому-либо компоненту или химическому соединению. Кривая Та – Е показывает температуру начала кристаллизации в системе компонента А из расплава при его охлаждении, кривая Е – Тв – соответственно начала кристаллизации компонента В.
Точка Е носит название точки эвтектики и характеризует состав расплава с минимальной для данной системы температурой существования жидкой фазы, расплав эвтектического состава. Этот расплав пересыщен одновременно по отношению к обоим компонентам А и В. При кристаллизации расплава эвтектического состава компоненты выделяются в твердой фазе всегда в строго определенном соотношении, определяемом положением точки эвтектики.
Горизонтальная линия, проведенная при температуре Т2 от линии ликвидуса до вертикали выпадающей твердой фазы, носит название конноды.
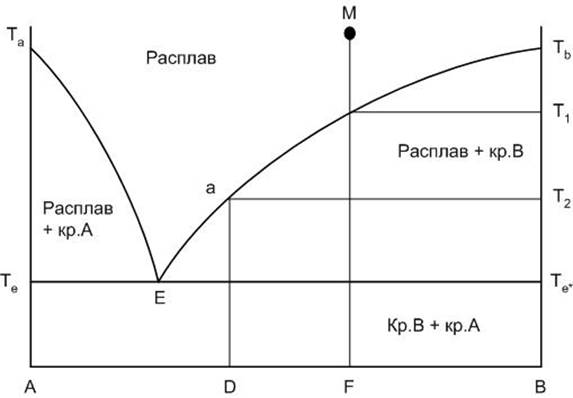
Рисунок 2. Диаграмма двухкомпонентной системы
Линия Те – Е – Те* носит название линии солидуса. Это линия окончания кристаллизации или начала плавления любого бинарного состава системы. Ниже линии солидуса в равновесии могут находиться только фазы в твердом состоянии. Следует также отметить, что линия солидуса не всегда горизонтальна.
Основными элементами кривых охлаждения являются точка перегиба и горизонтальная площадка.
Точка перегиба кривой охлаждения при постоянной скорости охлаждения появляется в том случае, когда изменяется скорость охлаждения. А это, в свою очередь, связано с началом протекания в системе процессов, сопровождающихся тепловыми эффектами, имеющих, как правило, экзотермический характер при охлаждении системы. Дополнительное выделение тепла снижает скорость охлаждения системы и угол наклона (между кривой охлаждения и абсциссой графика) увеличивается.
Для бинарных систем изменение угла наклона кривой охлаждения связано прежде всего с началом кристаллизации одной кристаллической фазы: компонента или химического соединения.
