Основы фотометрии
Фотометрические методы анализа относятся к обширной группе методов молекулярной абсорбционной спектрометрии и основаны на избирательном поглощении света растворами анализируемых веществ или соединений.
При поглощении света происходит перестройка энергетических состояний поглощающих свет молекул. Характеристические сигналы, обусловленные изменениями энергетических состояний молекул и составляют основу для получения аналитической информации о характеристических свойствах вещества и его содержании. Энергия поглощенного кванта Е=hν в ультрафиолетовой и видимой областях оптического диапазона, составляющая 1–5 эВ, расходуется, в основном, на электронные переходы, хотя переходу электронов всегда сопутствуют изменения колебательной и вращательной энергий поглощающих свет молекул. При поглощении света молекулы переходят в возбужденное состояние и приблизительно через 10–10–10–12 сек самопроизвольно (спонтанно) переходят в прежнее стабильное состояние и готовы к поглощению следующего кванта света. Поглощенная энергия, в основном, рассеивается в виде тепла или расходуется при столкновении возбужденных молеку с молекулами растворителя и других веществ, содержащихся в растворе. Кроме того, поглощенная энергия, преимущественно в ультрафиолетовой области, может вызывать и фтотохимические реакции, которые также используют в аналитической химии для определения как неорганических, так и органических соединений.
Названием фотометрические методы традиционно объединяют только фотоколориметрию и спектрофотометрию, которые имеют одну и ту же основу, но из-за особенностей аппаратурного оформления обладают различными возможностями.
Фотоколориметрия основана на поглощении полихроматического света различных длин волн (Δl≈50–100 нм) в видимой области спектра (400–750 нм) и применяется только для количественного определения окрашенных веществ в растворах.
В спектрофотометрии используется поглощение монохроматического света определенных длин волн (Δl≈1 нм) как в видимой, так и в ультрафиолетовой областях спектра. Кроме того, спектрофотометрию можно применять как для анализа веществ, так и для определения состава светопоглощающих соединений и их фотометрических и термодинамических характеристик.
Спектрофотометрические измерения по точности выше фотоколориметрических и примерно на порядок выше по чувствительности при прочих равных условиях. При спектрофотометрических измерениях легче обеспечить требуемую селективность определения.
Различают прямые и косвенные фотометрические методы. В прямых методах неизвестное содержание аналита определяют либо по собственному поглощению света, либо его переводят в светопоглощающую аналитическую форму в результате реакции комплексообразования (реже – реакции окисления-восстановления) с соответствующим фотометрическим реагентом R:
Меопр + Rизбыток ⇄ МеR.
Наиболее распространенными светопоглощающими продуктами фотометрических реакций являются следующие:
§ хелатные соединения металлов с хелатообразующими органическими реагентами,
§ соединения металлов с кислотными или оснόвными органическими красителями,
§ разнолигандные комплексные соединения и ионные ассоциаты.
Объединяет все химические реакции образования фотометрических аналитических форм общее требование: наличие у фотометрируемых соединений хромофорных групп атомов, которые способны поглощать кванты света определенных длин волн за счет электронных переходов из основного состояния в возбужденное.
В косвенных методах применяют различные варианты, но чаще всего используют вспомогательные светопоглощающие соединения Ме*R, с которыми аналиты Me (катион) или А (анион) взаимодействует по реакциям катионного или анионного обмена, не образуя при этом светопоглощающих соединений:
Ме*R + Ме ⇄ МеR + Ме*,
Ме*R + А ⇄ Ме*А + R.
В результате этих реакций концентрация вспомогательного светопоглощающего соединения Ме*R (и соответственно, аналитический сигнал) уменьшается пропорционально концентрации вступившего в обменную реакцию аналитов Ме или А. В некоторых случаях определяемый компонент осаждают в виде малорастворимого соединения и после растворения выделенного осадка определяют эквивалентное количество осадителя.
Полнота перевода аналита в светопоглощающее (окрашенное) соединение
При образовании светопоглощающего соединения аналит и фотометрический реагент одновременно могут участвовать и в побочных конкурирующих реакциях с растворителем (водой) и другими компонентами, содержащимися в анализируемом растворе. Даже в самом благоприятном случае, когда посторонние компоненты отсутствуют, конкурирующими реакциями могут быть реакции гидроксокомплексо-образования катиона металла и протонизации фотометрического реагента. Эти побочные реакции уменьшают степень связанности аналита в светопоглощающее соединение. Допустимую степень протекания побочных конкурирующих реакций можно легко установить с помощью условных констант устойчивости образующихся светопоглощающих соединений. Взаимосвязь условных констант устойчивости (β´) с концентрационными (β) осуществляется с помощью α-коэффициентов – мольных долей реакционных форм аналита Men+ и реагента R– от их суммарных равновесных концентраций с´Me и с´R во всех формах, не связанных в комплекс. Мольные α-доли рассчитывают с помощью функций закомплексованности или распределения.
Так, для реакции
Men+ + nR– ⇄ MeRn
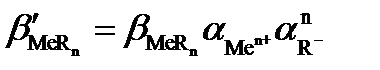 ,
,
где 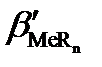 и
и 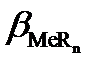 – условная и концентрационная константы устойчивости комплекса MeRn, соответственно.
– условная и концентрационная константы устойчивости комплекса MeRn, соответственно.
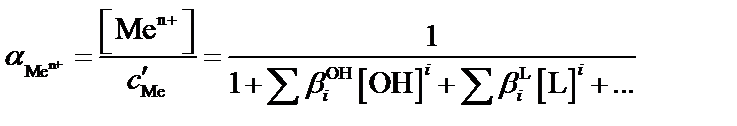 ,
,
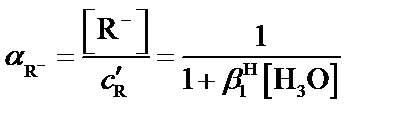 ,
,
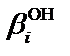 и
и 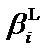 – общие концентрационные константы устойчивости комплексов
– общие концентрационные константы устойчивости комплексов 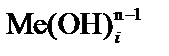 и MeLi; [L] – равновесная концентрация постороннего комплексанта (лиганда), моль×л–1;
и MeLi; [L] – равновесная концентрация постороннего комплексанта (лиганда), моль×л–1; 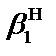 – константа протонирования аниона реагента R– (для рассматриваемой реакции
– константа протонирования аниона реагента R– (для рассматриваемой реакции 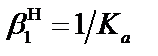 HR).
HR).
Учитывая реальные погрешности фотометрических методов, полнота протекания фотометрической реакции, при которой аналит переведен в светопоглощающую форму не менее, чем на 99%, обеспечивается теоретически соблюдением неравенства:
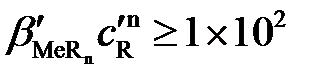 . (2.5)
. (2.5)
Основной закон светопоглощения и фотометрические характеристики
Поглощение монохроматического света окрашенным[†] раствором происходит в соответствии с основным законом светопоглощения:
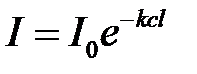 , (2.6)
, (2.6)
где I0 и I – интенсивность падающего и прошедшего через поглощающий слой света, соответственно; с – концентрация поглощающего вещества; l – толщина поглощающего слоя; k – коэффициент поглощения света.
Уравнение (2.6) часто называют объединенным законом Бугера-Ламберта-Бера, выражение которого обычно используют в логарифмической форме:
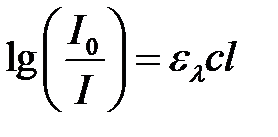 . (2.7)
. (2.7)
Величину lg(I0/I) называют оптической (абсорбционной) плотностью раствора и обозначают символом А. Если концентрацию с выражают в моль×л–1, а толщину слоя l – в см, то el называют молярным коэффициентом (показателем) поглощения, л×моль–1см–1. I/I0 =Т – коэффициент пропускания света, обычно выражают в %. А и Т взаимосвязаны: А=–lgT.
Молярный коэффициент поглощения el является фундаментальной характеристикой светопоглщающего вещества, зависящей только от природы вещества, растворителя и длины волны поглощаемого света; он не зависит ни от концентрации раствора светопоглощающего вещества, ни от толщины поглощающего слоя.
Логарифмическое уравнение основного закона светопоглощения 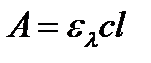 выражает прямолинейную зависимость аналитического сигнала – оптической плотности раствора от конентрации и лежит в основе всех количественных фотометрических методов.
выражает прямолинейную зависимость аналитического сигнала – оптической плотности раствора от конентрации и лежит в основе всех количественных фотометрических методов.
На практике, однако, наблюдается и отклонение от основного закона по физическим и химическим причинам. Основной физической причиной несоблюдения закона является нестрогая монохроматичность поглощаемого света и инструментальные погрешности его регистрации. Химические причины связаны с различными побочными реакциями, которые изменяют (уменьшают) степень связанности аналита в светопоглощающую форму, что и вызывает «кажущееся» нарушение основного закона.
Соблюдение основного закона светопоглощения можно проверить экспериментально, по прямолинейной графической зависимости А от с, либо измерив оптическую плотность раствора при разной толщине слоя l. Постоянство значений отношения A/l подтверждает соблюдение закона.
Важным дополнением к основному закону светопоглощения является правило аддитивности, согласно которому суммарная оптическая плотность раствора равна сумме парциальных оптических плотностей всех не взаимодействующих друг с другом светопоглощающих компонентов раствора:
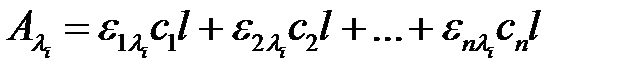 .
.
Это правило, известное в литературе, как принцип Фирордта, используется в тех случаях, когда в любой области спектра одновременно свет поглощают несколько компонентов и необходимо определить концентрацию каждого из них. При таких условиях при выбранных длинах волн составляют систему линейных уравнений по числу компонентов, решением которой и определяют концентрацию каждого из компонентов. Задача решается только с помощью спектрофотометрии.
Спектры поглощения
Спектрами поглощения называют графическое изображение распределения интенсивности поглощаемой световой энергии по длинам волн или частотам излучения. Спектры поглощения используют при решении многих аналитических задач, и прежде всего, при идентификации анализируемых соединений. Природа спектров поглощения в ультрафиолетовой (200–400 нм) и видимой (400–750 нм) областях спектра одинакова и связана, главным образом, с электронными переходами в поглощающих свет молекулах и ионах. В результате поглощения излучения молекула поглощающего вещества переходит из основного состояния с минимальной внутренней энергией в более высокое энергетическое состояние. При этом поглощенная энергия световых квантов ΔЕ=hν расходуется не только на изменение колебательной энергии ядер атомов, но главным образом, на движение (переход) электронов в электростатическом поле ядер атомов. Поэтому такие спектры поглощения называют электронными. Наиболее интенсивное движение происходит у валентных электронов внешних оболочек, так как они наиболее подвержены воздействию внешнего окружения вследствие межмолекулярного взаимодействия, взаимодействия с молекулами растворителя и фотометрического реагента. Эти взаимодействия сказываются на энергетическом состоянии поглощающей системы, молекулярные спектры поглощения практически полностью утрачивают тонкую линейчатую структуру, соответствующую отдельным переходам электронов, и приобретают форму широких полос (рис. 2.13). При этом основной вклад в уширение полос поглощения вносят наложения колебательных процессов, а также столкновения частиц, тепловое движение и естественное уширение, обусловленное резким уменьшением «времени жизни» возбужденного состояния молекулы, по сравнению с возбужденным состоянием отдельных атомов, которые имеют линейчатый спектр.
Согласно принципу неопределенности Гейзенберга
ΔЕ×Δt≈h,
(где h – постоянная Планка) у возбужденных атомов время «жизни» Δt~10–8 сек, а у возбужденных молекул вследствие значительно большей вероятности безызлучательных потерь энергии Δt~10–12–10–13 сек. Такое резкое уменьшение Δt на 5 порядков вызывает соответствующее возрастание величины ΔЕ, что и обусловливает естественное превращение отдельных линий в сплошную полосу. Так, при Δt≈10–8 сек Δλ≈10–3 нм, а при Δt≈10–13 сек Δλ≈100 нм. Вот такие полосы с полушириной максимумов поглощения порядка 50–100 нм и характерны для молекулярных спектров поглощения в видимой области спектра.
Электронные спектры поглощения соединений характеризуются определенным интервалом длин волн (полушириной полосы поглощения), который соответствует половинным значениям εmax ( 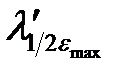 –
– 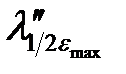 ) (см. рис. 2.13).
) (см. рис. 2.13).
| el |
| l, нм |
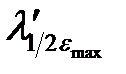 |
| emax |
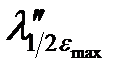 |
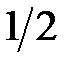 emax emax |
Рисунок 2.13 – Электронный спектр поглощения. 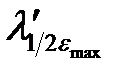 –
– 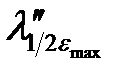 – размытость максимума поглощения (полуширина)
– размытость максимума поглощения (полуширина)
При качественной идентификации необходимым условием является достаточная контрастность фотометрической реакции идентифицируемых соединений. Под контрастностью фотометрической реакции понимают разность длин волн максимумов поглощения идентифицируемых соединений. Достаточной контрастностью принято считать величину Δλ=100нм. Это же условие относится и к фотометрическим реагентам. Лучшим фотометрическим реагентом считается тот, который при прочих равных условиях обеспечивает достаточную контрастность фотометрической реакции.
Фотометрические измерения
Принципиальная блок-схема фотометрических измерений показана на рис. 2.14.
| >> ═ |
| 4´ |
| I0 |
| I |
Рисунок 2.14 – Принципиальная блок-схема фотометрического прибора (фотоколориметра, спектрофотометра) с прямым способом измерения: 1 – источник света (лампа накаливания, водородная или ртутная лампа); 2 – фокусирующая линза; 3 – светофильтр или монохроматор; 4, 4´ – кюветы с раствором сравнения и анализируемым раствором, соответственно; 5 – фотоэлемент; 6 – усилитель фототока; 7 – регистрирующее устройство
Световой поток от источника (1) интенсивностью I0, выделенный светофильтром или монохроматором 3, проходит через поглощающий раствор 4, в котором частично поглощается, отражается и рассеивается, а остальная часть потока I, прошедшего через поглощающий слой, после преобразования в фототок измеряется регистрирующим устройством 7. Эта принципиальная схема в аппаратурном оформлении реализуется в двух вариантах.
1. В однолучевых приборах, как показано на рис. 2.14, светопоглощение анализируемых растворов и холостых фоновых растворов (растворов сравнения) измеряется поочередно и их разность учитывается регистрирующим устройством или самим экспериментатором.
2. В двухлучевых приборах (см. рис. 2.15) как в фотоколориметрах, так и в спектрофотометрах, световой поток от источника света с помощью призм и зеркал распределяется на два параллельных потока, один из которых проходит через анализируемые растворы, а второй – через раствор сравнения (фона). Разность в светопоглощении этих растворов учитывается регистрирующим устройством автоматически или путем соответствующей компенсации.
| > ═ |
| 4´ |
| 5´ |
| 6´ |
| 7´ |
Рисунок 2.15 – Принципиальная схема двухлучевого фотоколориметра с компенсационным способом измерения: 1 – источник света; 2 – светофильтр; 3 – призма; 4, 4´ – зеркала; 5, 5´ – кюветы с раствором сравнения и фотометрируемым раствором, соответственно; 6, 6´ – щелевые диафрагмы, связанные отсчетной шкалой; 7, 7´ – фотоэлементы; 8 – усилитель фототока; 9 – нуль-индикатор
Наиболее точные результаты измерений оптической плотности раствора, где наблюдаются небольшие погрешности, можно получить в интервале значений от 0.3 до 1.2. При А.=0.43 погрешность измерения А минимальна.
Назначение и правила выбора светофильтра
Для обеспечения максимальной чувствительности фотометрического определения необходимо обеспечить наибольшее значение аналитического сигнала A=lg(I0/I), а он обеспечивается при наименьшем значении величины прошедшего через поглощающий раствор света I. Для этих целей используют монохроматический свет, либо применяют узкополосные светофильтры, которые из светового потока I0 выделяют (пропускают к раствору) только тот интервал длин волн, которые максимально поглощаются раствором, т.е. светофильтр должен пропускать только такие длины волн света, которые максимально поглощаются анализируемым раствором при условии, что используемый фотометрический реагент R в этой области света не поглощает (рис. 2.16).
Если спектры поглощения фотометрируемого соединения и применяемого фотометрического реагента R перекрываются, то оптимальный интервал длин волн, пропускаемый светофильтром, соответствует максимальной разности Δe или ΔА между фотометрируемым раствором и реагентом (рис. 2.17).
| А, el |
| l, нм |
| 0.1 |
| 0.2 |
| 0.3 |
Рисунок 2.16 – Спектры поглощения фотометрируемого раствора (1) и правильно выбранного светофильтра (2)
| А, el |
| l, нм |
| Δl |
Рисунок 2.17 – Определение оптимального интервала длин волн (Δl) пропускания светофильтра при перекрывании спектров поглощения фотометрируемого раствора (1) и реагента (2)
При этом оптическую плотность анализируемых растворов нужно обязательно измерять относительно раствора реагента той же концентрации, либо оптическую плотность раствора реагента измерять отдельно и ее вычитать из суммарной плотности:
АМеR = AMeR+R – AR.
Оптимальный интервал рН раствора для проведения фотометрической реакции
Химические реакции определяемых элементов с фотометрическими реагентами, не обладающими кислотно-основными свойствами или являющимися анионами сильных кислот, целесообразно проводить в достаточно кислых средах, где протонизация реагента практически отсутствует, а степень гидроксокомплексообразования катионов металлов минимальна, и следовательно, создаются оптимальные условия для максимальной относительной устойчивости фотометрируемых соединений.
В тех случаях, когда в качестве фотометрического реагента используется анион слабой кислоты, оптимальный интервал рН раствора выбирается таким, где суммарный эффект протонизации реагента и гидроксокомплесообразования определяемого катиона будет минимальным, т.е. при таком рН, где условная константа устойчивости (β'МеR) фотометрируемого комплекса будет максимальна. Графически этот интервал ΔрН определяется из зависимости А=f(pH) (см. рис. 2.18).
| А (ΔА) |
| рН |
| рН1 |
| рН2 |
Рисунок 2.18 – Графическое определение оптимального интервала рН (ΔрН) при фотометрических определениях: ΔрН = рН1 ÷ рН2
Органические реагенты и растворители, применяемые в фотометрическом анализе
В реакциях образования аналитических форм в фотометрии предпочтение отдается органическим реагентам, особенно таким, которые одновременно содержат хромофорную и хелатообразующую функциональные группы. У большинства таких регентов в составе хелатообразующей группы содержится атом (ион) водорода, способный эквивалентно замещаться ионом металла, который одновременно координационно связывается с одним из донорных атомов реагента (O, N, S) другой функциональной группы, образуя циклическую структуру, характерную для хелатных комплексов маталла. Наиболее устойчивыми в водных растворах являются хелаты с 5- и 6-членными кольцами (циклами).
Во многих случаях при взаимодействии ионов металлов Me с хелатообразующими реагентами образуются незаряженные хелаты состава MeLn, называемые внутрикомплексными соединениями, которые, как правило, плохо растворимы в воде. Такие нейтральные хелаты являются очень перспективными в экстракционной фотометрии, т.к. позволяют совместить экстракционное концентрирование с селективным фотометрическим определением.
Большинство органических реагентов являются групповыми, но варьированием условий образования их окрашенных аналитических форм можно добиться достаточно высокой степени селективности. Наибольшее распространение получили реагенты трифенилметанового ряда и азокрасители.
Особую группу реагентов представляют органические реагенты, модифицированные поверхностно-активными веществами (ПАВ). К числу ПАВ относят органические вещества имеющие так называемое дифильное строение, т.е. одновременно содержащие полярную и неполярную (гидрофобную) функциональные группы. Применение таких модифицированных органических реагентов во многих случаях позволяет значительно увеличить чувствительность и селективность определений. Применение органических реагентов с ПАВ наглядно иллюстрирует рис. 2.19.
Органические растворители в фотометрическом анализе применяют для увеличения растворимости некоторых реагентов и окрашенных соединений и экстракционного выделения. Для экстракционного выделения и концентрирования аналитов применяются неполярные органические растворители, несмешивающиеся с водой (хлороформ, тетрахлорметан, бензол и др.). Полярные органические растворители, смешивающиеся с водой (ацетон, диоксан, этиловый спирт и др.), обычно используют для повышения растворимости и относительной устойчивости окрашенных соединений, а следовательно, для повышения чувствительности и точности фотометрических определений. Добавление полярного растворителя к воде уменьшает диэлектрическую проницаемость среды и способствует относительному упрочнению малоустойчивых комплексов, уменьшая степень их диссоциации.
| А |
| l, нм |
| RMПАВ |
| 0.8 |
| 0.4 |
| RM |
| R |
| Be | |||||||||||||||||
| Mg | Al | Si | P | ||||||||||||||
| Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | ||||
| Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | |||||
| La | Hf | Ta | W | Os | Pt | Au | Hg | Tl | Pb | Bi | |||||||
Рисунок 2.19 – Элементы, определяемые фотометрическим методом с применением ПАВ, и типичные изменения в электронных спектрах поглощения: М – аналит; R – реагент; ПАВ – поверхностно-активное вещество
Чувствительность фотометрических определений
Понятие «чувствительность определения» часто распространяют на различные характеристики, применяемые для количественной оценки возможности определения минимального содержания элемента фотометрическим методом.
Исходя из выражения основного закона светопоглощения, чувствительность фотометрической реакции выражают минимальной концентрацией смин (в мкг×мл–1) и определяемым минимумом m (в мкг):
смин = 103АминМμ/ell (2.9)
m = сминV = 103АминМμV/ell, (2.10)
здесь Амин – наименьшее значение оптической плотности раствора, надежно регистрируемое измерительным прибором; М и μ –молярная масса и число атомов определяемого элемента, содержащихся в молекуле светопоглощающего соединения; V – значение конечного (общего) объема фотометрируемого раствора, мл; el – молярный коэффициент поглощения; l – толщина поглощающего слоя, см.
Чем меньше минимальная оптическая плотность, надежно измеряемая прибором, и чем больше значения el и l, тем выше чувствительность при прочих равных условиях. Основным фактором, влияющим на чувствительность определения, является молярный коэффициент светопоглощения el.
Значения el изменяются в широких пределах, достигая максимально 1×105 – 1.2×105 л×моль–1×см–1. Поэтому при определении очень малых концентраций ~1×10–7 моль×л–1 используют фотометрические реагенты, образующие с определяемыми ионами комплексные соединения с
el ≈ 5×104 – 1×105 л×моль–1×см–1 и кюветы с максимальной толщиной слоя l. Кроме того, химическую реакцию образования комплексного соединения проводят при таких условиях (рН раствора, избыток реагента и т.п.), когда аналит количественно переведен в светопоглощающую форму:
Очень эффективным способом повышения чувствительности и селективности определения является применение органических фотометрических реагентов, модифицированных ПАВ.
Определяемый минимум m характеризует наименьшее массовое содержание вещества, которое еще можно определить по данной методике. Если в уравнении (2.10) V/l=q принять за «эффективное» сечение кюветы (в см2), то определяемый минимум можно записать в такой форме:
m = 103Амин qМμ/el, мкг×см–2.
Приняв Амин=0.001 и отнеся определяемый минимум к эффективному сечению кюветы 1см2, Сендел ввел в аналитическую практику самое простое выражение условного определяемого минимума (в мкг×см–2):
mS =μM/el,
которое очень удобно использовать при оценке фотометрических реагентов.
Условная чувствительность по Сенделу определяется числом микрограммов опредляемого элемента, превращенного в светопоглощающее соединение, которое в слое раствора с поперечным сечением 1 см2 показывает оптическую плотность, равную 0.001.
