Задачі для самостійного розв’язування
10.1Визначте масу води і літій сульфату, необхідні для приготування 270 г 20% -го розчину цієї солі.
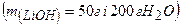
10.2 Визначте масу цукру та 10%-го його розчину, необхідні для виготовлення 270 г 20%-го розчину.
(маса цукру – 30 г, маса 10% розчину – 240 г)
10.3 Яку масу калій нітрату і води потрібно взяти, щоб приготувати 150 г насиченого при 40°С розчину, враховуючи, що 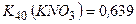 ?
?
(маса калій нітрату: 58,48 г і маса води – 91,52 г)
10.4 Скільки грамів кальцій хлориду і води необхідно взяти для приготування 200 г 1%-го розчину?
(кальцій хлориду – 2 г, і 192 г води)
10.5 Мідний купорос 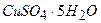 масою 50 г розчинили у воді масою 200 г. Визначте масову частку купрум (ІІ) сульфату в розчині.
масою 50 г розчинили у воді масою 200 г. Визначте масову частку купрум (ІІ) сульфату в розчині.
( 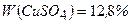 )
)
10.6 Визначте масу натрій оксиду, яку треба розчинити в 414 г води, щоб утворився 40%-ий розчин їдкого натру.
(маса натрій оксиду 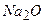 дорівнює 186 г)
дорівнює 186 г)
10.7 Визначте масову концентрацію у відсотках сульфатної кислоти у розчині, який утвориться при розчиненні 100 г сульфатного ангідриду в 150 г води.
( 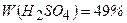 )
)
10.8 Який об’єм концентрованої сульфатної кислоти 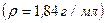 з масовою часткою кислоти 98% необхідно взяти для повного розчинення 8 г міді?
з масовою часткою кислоти 98% необхідно взяти для повного розчинення 8 г міді?
(необхідно взяти масу розчину 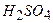 - 13,58 мл)
- 13,58 мл)
10.9 Знайти молярну концентрацію сульфатної кислоти в розчині масою 150 г, з масовою часткою 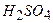 20%, густиною 1,139 г/мл.
20%, густиною 1,139 г/мл.
(C (H2SO4) = 2,32 моль/л)
10.10Густина 5,5 М розчину 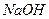 дорівнює 1,2 г/мл. Визначте масову частку натрій гідроксиду в цьому розчині.
дорівнює 1,2 г/мл. Визначте масову частку натрій гідроксиду в цьому розчині.
( 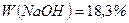 )
)
10.11Скільки мілілітрів 10% розчину KNO3 густиною
1,12 г/мл потрібно для приготування 2 л 0,1 М розчину?
(V = 180,36 мл)
10.12Скільки мілілітрів 2 М розчину AlCl3 потрібно для приготування 3 л 3 % розчину густиною 1,05 г/мл?
(V = 353,93 мл)
10.13ДР (PbІ2) = 8∙10-9. Обчисліть концентрацію йонів у насиченому розчині.
(С(Pb2+)=1,3∙10-3 моль/л; C(І-) = 2,6∙10-3 моль/л)
10.14 Змішали 100 г 1 % розчину NaCl густиною 1,02 г/мл та 200 мл 0,002 М розчину AgCl. Чи випаде осад? ДР (AgCl) = 1,7∙10-10.
(осад випаде)
10.15Визначте рН 0,025 М розчину Ba(OH)2.
(рН = 12,7)
10.16Визначте молярну концентрацію Н2SO4, якщо дано розчин з рН = 4.
(С(H2SO4) = 5∙10-5 моль/л)
Тест № 1
10.1 Розподіліть (умовно) нижче вказані речовини по здатності до розчинності у воді: а)добре розчинні; б) малорозчинні; в)практично нерозчинні.
5) цукор
6) аргентум хлорид
7) мідний купорос
8) кухонна сіль
9) гіпс
10.2Під час розчинення у воді твердих речовин із підвищенням температури його розчинність як правило, а розчинність газоподібних речовин - . . .
10.3 На розчинність 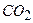 у воді не впливає:
у воді не впливає:
2) тиск
5) температура
6) швидкість пропускання струму газу
7) хімічна взаємодія газу з водою.
10.4 Розчинність речовин в ряді 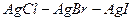
1) збільшується;
2) зменшується;
3) не зменшується;
4) збільшується, а потім зменшується.
10.5 Ступінчасту дисоціацію для наведених нижче кислот, основ і солей можна написати наступним чином:
2) 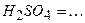
3) 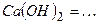
4) 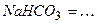
5) 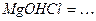
10.6 Рівняння електролітичної дисоціації наступних сильних електролітів:
1) 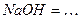
2) 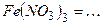
3) 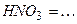
4) 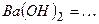
Тест № 2
10.1 Із реакцій, які наведені нижче, практично до кінця ідуть:
1) 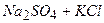
2) 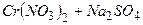
3) 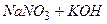
4) 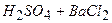
10.2Яка з речовин у водному розчині дисоціює з утворенням йону 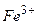 ?
?
а) 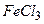 ; б)
; б) 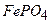
10.3 Як за допомогою якісних реакцій розпізнати натрій карбонат, натрій бромід, натрій йодид? Запропонуйте послідовність проведення реакцій, складіть відповідні молекулярні та йонні рівняння.
10.4 Як за допомогою якісних реакцій розпізнати барій хлорид, хлоридну кислоту та натрій хлорид? Запропонуйте послідовність проведення реакцій, складіть відповідні молекулярні та йонні рівняння.
10.5 Як за допомогою якісних реакцій розпізнати натрій силікат, натрій хлорид, барій хлорид? Запропонуйте послідовність проведення реакцій, складіть відповідні молекулярні та йонні рівняння.
10.6 Якими парами речовин необхідно скористатись, щоб добути алюміній гідроксид: а) 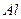 і
і 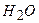 ; б)
; б) 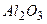 і
і 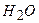 , в)
, в) 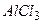 і
і 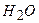 ?
?
1) а; 2) б; 3)в; 4) а, б; 5) а, б; 6) б, в.
10.7 Яким набором реактивів можна визначити якісний склад амоній сульфату: а) 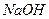 і
і 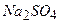 ; б)
; б) 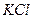 і
і 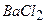 ; в)
; в) 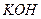 і
і 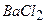 ?
?
1) а; 2) б; 3)в.
Складіть рівняння реакцій в йонній та молекулярній формі.
10.8Яка з реакцій йонного обміну відбувається в розчині практично до кінця:
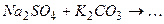
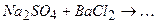
Складіть рівняння реакцій в йонній та молекулярній формі.
10.9 Дано речовини: натрій нітрат, хлоридна кислота, купрум (ІІ) оксид, цинк. Як можна добути з наведених речовин та продуктів їх взаємодії дві прості і дві складні речовини? Запишіть відповідні рівняння реакцій.
10.10 Дано речовини: хлоридна кислота, алюміній гідроксид, магній, натрій гідроксид, хром (ІІІ) оксид. Як можна добути з наведених речовин та продуктів їх взаємодії дві прості і дві складні речовини? Запишіть відповідні рівняння реакцій.
Тема 11 ГІДРОЛІЗ СОЛЕЙ
Приклад 1. Вкажіть, які з наведених нижче солей гідролізують: а) 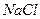 , б)
, б) 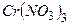 , в)
, в) 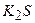 ; г) СН3СООNH4? Для кожної з солей, які гідролізують, напишіть в молекулярній і йонно-молекулярній формах рівняння гідролізу всіх можливих стадій процесу і вкажіть реакцію (рН) водного розчину солі.
; г) СН3СООNH4? Для кожної з солей, які гідролізують, напишіть в молекулярній і йонно-молекулярній формах рівняння гідролізу всіх можливих стадій процесу і вкажіть реакцію (рН) водного розчину солі.
Відповідь:
a) Солі, які є похідними сильних основ і кислот, не гідролізують, оскільки їх йони (катіони і аніони) не зв’язують йони води ( 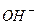 чи
чи 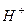 ), а отже, і не зміщують її йонну рівновагу. Тому сіль
), а отже, і не зміщують її йонну рівновагу. Тому сіль 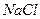 не гідролізує, розчин цієї солі нейтральний (
не гідролізує, розчин цієї солі нейтральний ( 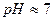 ).
).
б) Сіль 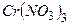 утворена слабкою основою і сильною кислотою. Вони гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. Розчини таких солей мають кислу реакцію (
утворена слабкою основою і сильною кислотою. Вони гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. Розчини таких солей мають кислу реакцію ( 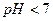 ).
).
І стадія
Молекулярне рівняння:
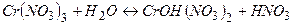
Йонне рівняння:
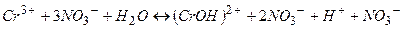
Йони 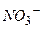 не приймають участі в процесі гідролізу.
не приймають участі в процесі гідролізу.
Скорочене йонне рівняння:
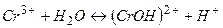 (
( 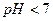 )
)
Як видно, в результаті реакції з’являється надмір водневих йонів, що зумовлює кислий характер розчину. За звичайних умов цей процес протікає в основному по І стадії, але при зміні умов можливий багатостадійний процес (друга та третя стадії).
ІІ стадія
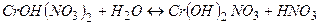
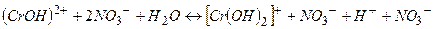
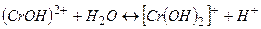 (
( 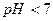 ).
).
ІІІ стадія
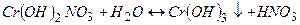
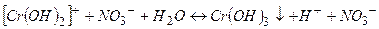
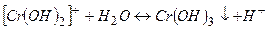 (
( 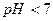 ).
).
в) При гідролізі солі 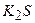 утворюється деякий надлишок йонів
утворюється деякий надлишок йонів 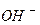 і тому розчини солей, утворених сильною основою і слабкою кислотою, мають лужну реакцію (
і тому розчини солей, утворених сильною основою і слабкою кислотою, мають лужну реакцію ( 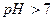 ). Реакція протікає постадійно.
). Реакція протікає постадійно.
І стадія
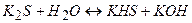
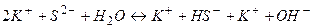
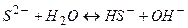 (
( 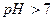 )
)
ІІ стадія
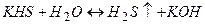
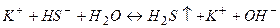
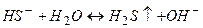 (
( 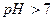 )
)
г) Одним з варіантів гідролізу є солі утворені слабкою основою та слабкою кислотою, наприклад (NH4)2CO3, CH3COONH4, Al2S3). Під час гідролізу амоній ацетату CH3COONH4 ацетат-іони зв’язують йони Н+, утворюючи слабкодисоційовану оцтову кислоту CH3COOH; амоній-іони NH 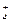 зв’язують йони ОН− утворюючи слабку основу – амоній гідроксид NH4OH:
зв’язують йони ОН− утворюючи слабку основу – амоній гідроксид NH4OH:
CH3COONH4,+H2O↔ NH4OH+CH3COOH
CH3COO−+ NH 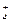 ↔ CH3COOH+ NH4OH
↔ CH3COOH+ NH4OH
Реакція розчину залежить від константи дисоціації продуктів гідролізу – основи та кислоти. У цьому разі константи дисоціації NH4OH і CH3COOH приблизно рівні. Тому реакція розчину є нейтральною.
Солі слабкої основи та слабкої кислоти підлягають гідролізу, реакція розчину залежить від співвідношення констант дисоціації продуктів гідролізу.
Стан рівноваги реакції гідролізу характеризується ступенем гідролізуP, що дорівнює відношенню концентрації тієї частини солі, яка вступила в реакцію гідролізу Сгідр, до загальної концентрації розчиненої солі (C):
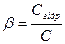
Ступінь гідролізу залежить насамперед від природи розчиненої солі: чим слабкіші кислота і основа, що утворили сіль, тим сильніше відбувається зв'язування йонів H+ і OH− з відповідними ионами солі і тим вищий ступіньгідролізу p.
З підвищенням температуриендотермічний процес дисоціації води посилюється, рівновага зміщується в бік утворення йонів H+ і OH−. Збільшення концентрації йонів, що утворюються внаслідок дисоціації води, посилює процеси зв'язування їх з катіонами або аніонами солі, і ступінь гідролізу P зростає.
Якщо в розчині солі, що зазнала гідролізу, підвищити концентрацію одного з продуктів реакції,то рівновага гідролізу, за принципом Ле Шательє, зміститься в бік вихідної солі і ступінь гідролізу зменшиться. Наприклад, якщо до розчину ацетату натрію додати гідроксид натрію, концентрація йона OH− збільшиться; рівновага гідролізу цієї солі (див. наведене вище рівняння гідролізу) зміститься таким чином, щоб послабити збільшення концентрації цих йонів, тобто в бік вихідних речовин, і ступінь гідролізу зменшиться.
Від розбавленняводою кількість частинок розчиненої речовини в одиниці об'єму зменшується і рівновага гідролізу змішується в такому напрямі, щоб послабити зменшення кількості частинок розчиненої речовини. Якщо під час гідролізу з одного
йона розчиненої солі утворюються дві частинки розчиненої речовини (див. йонні рівняння гідролізу ацетату натрію, карбонату натрію, хлориду цинку), то рівновага таких реакцій зсувається В бік утворення продуктів (більшого числа частинок) і ступінь гідролізу зростає. При перебігу гідролізу солі слабкої основи і слабкої кислоти число частинок розчиненої речовини у розчині не змінюється (див. рівняння гідролізу ацетату амонію), тому рівновага гідролізу від розбавлення не зміщується.
