Тема 4.1. Одноатомні спирти
План
1. Визначення та загальна формула класу.
2. Будова.
3. Номенклатура.*
4. Ізомерія.*
5. Фізичні властивості.
6. Хімічні властивості.**
7. Добування.*
8. Застосування.
1. Спирти можна розглядати як похідні вуглеводнів, у яких атом Гідрогену заміщений на гідроксильну групу –ОН.
Залежно від будови вуглеводневого радикалу розрізняють насичені, ненасичені, ароматичні спирти, а за кількістю гідроксильних груп – одно- і багатоатомні.
Загальна формула насичених одноатомних спиртів СnH2n+1OHабо СnH2n+2O.
2.Зв'язок О—Н поляризований, оскільки атом більш електронегативного атома Оксигену відтягує до себе електронну густину зв'язку. Внаслідок поляризації на атомі Гідрогену утворюється частковий позитивний, а на атомі Оксигену – частковий негативний заряд:
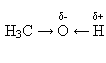
3.Нумерація ланцюга здійснюється з того боку, куди ближче гідроксогрупа. До назви відповідного алкану додається суфікс –ол. Після назви цифрою зазначається місце гідроксогрупи.
4. Структурна ізомерія: а) карбонового скелета
бутанол-1 2-метилпропанол-1
СН3−СН2−СН2−СН2ОН СН3 −СН−СН2ОН
|
СН3
б) положення функціональної групи
бутанол-1 бутанол-2
СН3−СН2−СН2−СН2ОН СН3 −СН2−СНОН −СН3
Ізомерія з етерами:
СН3−О−СН3 СН3−СН2ОН
Диметиловий етер етанол
5.Спирти, які містять в молекулі до 15 атомів Карбону є рідинами, більше 15 – твердими речовинами. Нижчі спирти нерозчинні у воді, вищі практично нерозчинні. Серед спиртів, на відміну від вуглеводнів, немає газуватих речовин. Температури плавлення і кипіння спиртів значно вищі порівняно з вуглеводнями з такою самою відносною молекулярною масою
6. Хімічні властивості спиртів:
І. Горіння: С2Н5ОН +3О2 → 2СО2 + 3Н2О
ІІ. Взаємодіють з активними металами, утворюючи алкоголяти:
2C2H5OH + 2Na → 2C2H5ONa + H2
ІІІ. Реакції естерифікації – реакція взаємодії кислот з спиртами:
СН3СООН +НОСН3 → СН3СООСН3 + Н2О
ІV. Гідрогалогенування: C2H5OH + HBr → C2H5Br + H2O
V. Окиснення (CuO, KMnO4):
А) первинний спирт → альдегіди: C2H5OH + СuO → CH3−C=O + Cu + H2O
|
H
Б) вторинний спирт → кетони: CH3−C−CH3 + СuO → CH3−C−CH3 + Cu + H2O
| ||
OH O
В) третинний спирт → практично не окислюються
VІ. Дегідратація – процес відщеплення молекули води:
А) внутрішньомолекулярна з утворенням алкенів
Правило Зайцева: Гідроген відщеплюється від менш гідрогенізованого атома Карбону
C2H5OH → CH2= CH2 + H2O
Б) міжмолекулярна з утворенням етерів:
C2H5OH + C2H5OH → C2H5−O−C2H5 + Н2О
В) Реакція Лебедєва:
2C2H5OH → CH2=CH−CH=CH2 + 2H2O + H2
бутадієн-1,3
7.Загальні методи добування:
OH–
1) гідроліз галогенпохідних вуглеводнів: R–CH2–Cl + H2O → R–CH2–OH + HCl
2) відновлення альдегідів: R–C=O + H2 → R–CH2–OH
|
H
Методи добування метанолу: 1) суха перегонка
2) з синтез-газу: СО + 2Н2 → СН3–ОН
Методи добування етанолу:
1) спиртове бродіння глюкози: С6Н12О6 → 2С2Н5ОН + 2СО2
2) гідратація етилену: СН2=СН2 + Н2О → СН3–СН2–ОН
8. Метанол: у промисловому органічному синтезі; як розчинник; як додаток до бензину.
Етанол: для виробництва оцтової кислоти та бутадієну-1,3; як розчинник; у парфумах; у медицині; як паливо; у харчовій промисловості.
Контрольні запитання:
1. Які органічні речовини називають спиртами?
2. Загальна формула насичених одноатомних спиртів.
3. Які хімічні властвисоті притаманні одноатомним спиртам?
4. Що називають реакцією естерифікації?
5. При спалюванні 9,2 г органічної речовини утворилося 17,6 г вуглекислого газу і 10,8г води. Відносна тгустина пари за воднем 23. Виведіть молекулярну формулу.
6. Дегідратацією насиченого одноатомного спирту добули алкен симетричної будови з нерозгалуженим ланцюгом масою 8,4 г, який взаємодіє з бромом масою 24 г. Визначити структурну формулу вихідного спирту та назвати його.
Література:
1. Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 100-102.
2. Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІІ, Гл. 17, §§ 142-143, с. 147-149.
3. Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 39.
4. Березан О.В. Органічна хімія. – К.: Абрис, 2000. – Р. ІV, §§ 1-4, с. 86-90.
