Кислоты. Классификация кислот. Химические свойства.
Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.
В этом параграфе мы рассмотрим только важнейшие неорганические кислоты, то есть такие, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности.
Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение:
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
H2SO4+ Mg= MgSO4+ H2
серная кислота металл соль водород
Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
По первому признаку кислоты делятся на кислородсодержащие и бескислородные
Классификация кислот по составу.
| Кислородсодержащие кислоты | Бескислородные кислоты |
| H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
| Одноосновные | Двухосновные | Трехосновные |
| HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот. Об индикаторах мы более подробно расскажем в следующем параграфе на примере их реакций с основаниями.
2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
Кислота основание соль вода
H2SO4+ Ca(OH)2= CaSO4+ 2 H2
H3PO4 +Fe(OH)3= FePO4 + 3 H2O
2 H3PO4+ 3 Ca(OH)2= Ca3(PO4)2 +6 H2O
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл. 8-3). Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Табл. 8-3. Ряд активности металлов.
Металлы, которые вытесняют водород из кислот
Металлы, которые не вытесняют водород из кислот
K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H)
самые активные металлы
Cu Hg Ag Pt Au
самые неактивные металлы ®
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части табл. 8-3. Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части табл. 8-3.
В связи с этим существует еще одна классификация кислот – по силе. В таблице 8-4 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 8-4. Классификация кислот на сильные и слабые кислоты.
| Сильные кислоты | Слабые кислоты |
| HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Соли
В состав солей входят катионы Mn+ и кислотные остатки.
Если кислотный остаток не содержит водорода, соли называют средними, например:
CaSO4 - сульфат кальция
Pb(NO3)2 - нитрат свинца(II)
Ca3(PO4)2 - ортофосфат кальция
CuCO3 - карбонат меди(II)
La(NO3)3 - нитрат лантана(III)
Средние соли - продукты полной нейтрализации кислот основаниями:
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2↓ + 6H2O
Средние соли вступают в реакцию двойного обмена с кислотными и основными гидроксидами и с другими солями:
Ag2CO3 + 2HNO3 = 2AgNO3 + CO2↑ + H2O
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Реакции, приведенные выше, являются распространенными способами получения солей. Кроме того, средние соли образуются при взаимодействии металлов с кислотами:
Fe + H2SO4(разб.) = FeSO4 + H2↑
Cu + 4HNO3(конц.) = Сu(NO3)2 + 2NO2↑ + H2O
Соли, содержащие кислотные остатки с незамещенными атомами водорода, называются кислыми, например:
Ca(HSO4)2 - гидросульфат кальция
Fe(HCO3)2 - гидрокарбонат железа(II)
Ba(H2PO4)2 - дигидроортофосфат бария
BaHPO4 - гидроортофосфат бария
Кислые соли - продукты неполной нейтрализации:
Ba(OH)2 + 2H3PO4 = Ba(H2PO4)2 + 2H2O
Ba(OH)2 + H3PO4 = BaHPO4↓ + 2H2O
Возможна и дальнейшая нейтрализация кислых солей избытком оснóвного гидроксида:
Ba(H2PO4)2 + Ba(OH)2 = 2BaHPO4↓ + 2H2O
BaHPO4 + Ba(OH)2 = Ba3(PO4)2↓ + 2H2O
Соли, содержащие в своем составе гидроксогруппы, называются оснóвными, например:
Ca2SO4(OH)2 - дигидроксид-сульфат кальция
Cu2CO3(OH)2 - дигидроксид-карбонат димеди
Ti(NO3)2O - оксид-динитрат титана
Почти все оснóвные соли малорастворимы в воде.
Оснóвные соли - продукты неполной нейтрализации:
Co(OH)2 + HNO3 = CoNO3(OH) + H2O
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида, например:
CoNO3(OH) + HNO3 = Co (NO3)2 + H2O
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона (двойные соли) или аниона (смешанные соли). Примеры:
KAl(SO4)2 - сульфат алюминия-калия
Fe(NH4)2(SO4)2 - сульфат диаммония-железа(II)
LiAl(SiO3)2 - метасиликат алюминия-лития
Ca(ClO)Cl - хлорид-гипохлорит кальция
Na3CO3(HCO3) - гидрокарбонат-карбонат натрия
Na2IO3(NO3) - нитрат-иодат натрия
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
K2SO4 + MgSO4 + 6H2O = K2Mg(SO4)2 · 6H2O
Химические свойства СОЛЕЙ
Определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
BaCl2(тверд.) + H2SO4(конц.) = BaSO4↓ + 2HCl↑
NaHCO3 + HCl(разб.) = NaCl + CO2↑ + H2O
Na2SiO3 + 2HCl(разб.) = SiO2↓ + 2NaCl + H2O
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Cu+HgCl2=CuCl2+Hg
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
NaCl(разб.) + AgNO3 = NaNO3 +AgCl↓
3Na2SO3 + 4H2SO4(разб.) + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + 4H2O + K2SO4
Некоторые соли разлагаются при нагревании:
CuCO3=CuO+CO2↑
NH4NO3 = N2O↑ + 2H2O
Способы получения солей
1. Взаимодействие металла с кислотой.
Zn + 2HCl = ZnCl2 + H2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Взаимодействие основного оксида с кислотой
CaO + 2HCl = CaCl2 + 2H2O
FeO + H2SO4 = FeSO4 + H2O
2. Взаимодействие основания с кислотой (реакция нейтрализации).
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + H2O
При неполной нейтрализации кислоты основанием образуется кислая соль:
H2SO4 + NaOH = NaHSO4 + H2O
3. Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль. Для осуществления этой реакции необходимо, что бы взятая кислота была сильнее образующейся или менее летучей.
2NaCl + H2So4 = Na2SO4 + 2HCl↑
Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли:
Na2SO4 + H2SO4 = 2NaHSO4
CaCO3 + CO2 + H2O = Ca(HCO3)2
4. Взаимодействие основного оксида с кислотным оксидом.
CaО + SiО2 = CaSiO3
5. Взаимодействие основания с кислотным оксидом
6NaOH + P2O5 = 2Na3PO4 + 3H2O
6. Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции.
CaCO3 + SiO2 =t CaSiO3 + CO2 ↑
7. Взаимодействие соли с основанием. Этим способом можно получить как средние соли, так и, при недостатке основания, основные соли. Кислые соли, взаимодействуют с основанием, переходят в средние:
Fe(NO3)3 + 3NaOH = 3NaNo3 + Fe(OH)3 ↓
ZnCl2 + KOH = ZnOHCl + KCl
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
8. Взаимодействие между двумя солями. Образуются две новые соли. Реакция протекает до конца лишь в том случае, если одна из образующихся солей выпадает в осадок:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
AgNO3 + KJ = AgI↓ + KNO3
9. Взаимодействие между металлом и солью. Вступивший в реакцию металл должен находится в ряду напряжения металлов левее металла, входящего в состав исходной соли.
Fe + CuSO4 = FeSO4 + Cu
10. Взаимодействие металла с неметаллом
2Fe + 3Cl2 = 2FeCl3
11. Взаимодействие металла со щелочью.
Zn + 2NaOHкр  Na2ZnO2 + H2 ↑
Na2ZnO2 + H2 ↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
12. Взаимодействие металла со щелочью
Cl2 + 2KOH = KCl + KClO + H2O
13. Взаимодействие неметалла с солью.
Cl2 + KJ = 2KCl + J2
14. Термическое разложение солей.
2KNO3  2KNO2 + O2↑
2KNO2 + O2↑
2KClO3  2KCl + 3O2↑
2KCl + 3O2↑
56. Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счёт неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
а) полярные молекулы — NH3, Н2О, CO, NO;
б) простые ионы — F−, Cl−, Br−, I−, H+;
в) сложные ионы — CN−, SCN−, NO2−, OH−.
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Стереохимический подход — удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
Лига́нд (от лат. ligare — связывать) — атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Катионныекомплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов).
57. УстойчивостьКомплексные соединения в растворе определяется константой диссоциации К его комплексного иона:

(При записи константы диссоциации в квадратные скобки берут равновесные концентрации ионов). Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным атомом и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки — неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, [Fe (H2O)6]3+ и [Сr (H2O)6]3+ имеют почти одинаковые энергии связи Me — H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) — медленно.

Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости. Для записи константы нестойкости К уравнение диссоциации составляется обычным способом (без участия молекул воды):
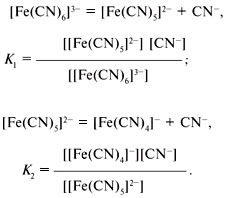
Аналогично составляются выражения для К3, К4, К5, К6, в которых квадратными скобками обозначены равновесные концентрации ионов.
Если справочные данные по ступенчатым константам нестойкости отсутствуют, пользуются общей константой нестойкости комплексного иона:

Общая константа нестойкости равна произведению ступенчатых констант нестойкости.
