Приготування робочого титрованого розчину кислоти
ЗАНЯТТЯ №16
ТЕМА: Введення в титриметричний аналіз. Техніка зважування на аналітичних терезах. Мірний посуд. Перевірка ємності мірного посуду. Кислотно-основне титрування. Приготування титрантів.
АКТУАЛЬНІСТЬ:Вміння використовувати мірний посуд і апаратуру, що застосовується в методі титриметричного аналізу, а також виготовлення і стандартизація робочих розчинів дає можливість застосовувати отримані навики при вивченні фармацевтичного, фітохімічного та хіміко-токсикологічного аналізу, є необхідними умовами для аналізу речовин і правильного трактування одержаних результатів досліджень.
НАВЧАЛЬНІ ЦІЛІ:Ознайомлення студентів з аналітичним посудом, що застосовується в титриметричному аналізі, аналітичними терезами та методами зважування на них. Освоєння методики приготування стандартних розчинів у методі нейтралізації.
ЗНАТИ: -типи скла для хімічного посуду;
-будову аналітичних терезів;
-правила зважування на аналітичних терезах;
-вихідні речовини для виготовлення стандартних розчинів;
-розрахунки величини наважки при виготовленні стандартних
розчинів.
ВМІТИ:-перевірити точність калібровки мірного посуду;
-встановити місткість мірного посуду за масою налитої і вилитої
води;
-перевіряти правильність калібровки мірного посуду – бюреток,
піпеток та колб;
-користуватись аналітичними терезами;
-виготовити стандартні розчини;
-правильно вибирати індикатори в методі кислотно-основного
титрування;
-виготовляти титровані розчини з вихідних речовин з розрахованим
титром та титровані розчини з встановленим титром з
концентрованих кислот;
-робити висновки з результатів аналізу і оформляти їх у
вигляді протоколу.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Предмет та задачі, принципи та методи кількісного аналізу. Значення методів кількісного аналізу для медицини, фармації та промисловості.
2.Типи скла для хімічного посуду.
3.Типи і призначення колб, бюреток і піпеток.
4.Правила роботи на аналітичних терезах.
5.Поняття про титриметричні методи аналізу, їх класифікація.
6.Як перевірити місткість мірного посуду (мірних колб, бюреток і піпеток)? Відповідь обґрунтуйте та запишіть.
7.Стандартні речовини і вимоги до них. Стандартні розчини, їх приготування і стандартизація.
8.Як мити і зберігати скляний мірний посуд?
9.Основні етапи розвитку кількісного аналізу, сучасний стан та перспективи розвитку.
10.Оцінка вірності результатів, абсолютна та відносна помилки. Вираження результатів вимірів у значащих числах.
11.Який об’єм хлоридної кислоти з молярною концентрацією 10,97 моль/дм3 необхідно взяти для приготування 100 см3 розчину з молярною концентрацією 0,5 моль/дм3?
12.Яку масу наважки бури Na2B4O7•10H2O необхідно взяти для приготування 250 см3 розчину з молярною концентрацією еквівалента 0,5 моль/дм3?
КОНТРОЛЬНІ ПИТАННЯ
1.Які існують способи виготовлення стандартних розчинів?
2.Правила вибору індикатора за продуктами реакції та кривими титрування. Відповідь обґрунтуйте та запишіть.
3.Напишіть, як виготовити стандартні розчини бури, хлоридної кислоти, натрію гідроксиду і як їх зберігати?
4.Що таке фіксанали, стандартні взірці (нормальні) і для чого їх використовують?
5.Що таке нормальність і коефіцієнт поправки стандартних розчинів?
6.Які існують способи вираження концентрації розчинів? Відповідь обґрунтуйте та запишіть.
7.У чому суть йонної, хромофорної та йонно-хрофофорної теорій індикаторів? Поясніть це, використовуючи хімічні формули індикаторів.
8.Що таке константа дисоціації індикатора? Наведіть приклади.
9.Що таке криві поправок для бюреток і як їх побудувати? Як ними користуватися?
10.Кислотно-основні індикатори, їх основні представники.
11.Показник титрування та інтервал переходу індикатора, зв’язок між ними.
12.Що таке молярна маса еквіваленту речовини і фактор еквівалентності? Чи постійні ці величини для речовин? Від чого вони залежать? Відповідь обґрунтуйте та запишіть.
13.Що таке титр розчину? Яка різниця між титром робочим і титром нормальним?
14.Що таке стандартні або титровані розчини?
15.Які вимоги до реакцій, що можуть використовуватися в титриметричному аналізі? Відповідь обґрунтуйте та запишіть.
16.Як розраховується титр заданої концентрації та титр за досліджуваною речовиною?
17.При перевірці калібровки мірної колби місткістю 100 см3 знайдено, що маса води, налитої у колбу до мітки, складала 99,85 г. Розрахуйте об’єм колби при 20˚С і визначте клас точності колби.
18.При калібровці піпетки місткістю 25 см3 знайдено, що маса вилитої з неї води становила 24,9761 г при 25˚С. Розрахуйте об’єм піпетки при 25˚С і 20˚С.
19.Який об’єм 40%-го розчину сульфатної кислоти (ρ = 1,32 г/см3) потрібно взяти для приготування 2 дм3 0,15М розчину?
20.У яких межах можуть коливатися величини рТ індикаторів, що застосовуються в методі нейтралізації і чим це можна пояснити?
21.Що означає індикаторна помилка титрування?
22.Як очистити від домішок натрію гідроксид, з якого треба виготовити титрований розчин і яким чином потрібно зберігати цей розчин в умовах аналітичної лабораторії?
23.Яким чином, не проводячи відповідних розрахунків, можна орієнтовно вирішити питання про те, який індикатор більш придатний для того чи іншого титрування?
24.Як впливають температура, неелектроліти (спирт, ацетон і т.д.), кількість індикатора та інші фактори на зміну забарвлення індикаторів?
25.Яким чином допомагають “свідки” для підвищення точності методів визначення?
26.Чому дорівнює титр хлоридної кислоти по кальцію оксиду, якщо на титрування 0,1144 г кальцію карбонату витрачається 24,65 см3 хлоридної кислоти?
27.На тирування 20 см3 розчину бури з молярною концентрацією 0,0500 моль/дм3 витрачено 16 см3 титранут – розчину хлоридної кислоти. Розрахуйте молярну концентрацію і титр розчину хлоридної кислоти.
рну і нормальну концентрацію 10%-го розчину нітратної кислоти з густиною 1,056 г/см3.
28.Який об’єм 60%-го розчину сульфатної кислоти (ρ = 1,51 г/см3) потрібно взяти для приготування 1 дм3 0,2М розчину?
29.Яку наважку безводного натрію карбонату необхідно взяти для приготування 100 см3 розчину з молярною концентрацією 0,01 моль/дм3? Визначте молярну концентрацію еквіваленту, титр натрію карбонату в розчині, а також титр натрію карбонату по нітратній кислоті.
30.Визначте молярну концентрацію, молярну концентрацію еквіваленту, титр і титр по натрію гідроксиду розчину оксалатної кислоти об’ємом 200 см3, виготовленого за точною наважкою з масою (Н2С2О4•2Н2О) = 1,2607 г для стандартизації розчину натрію гідроксиду.
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Ознайомитись з видами хімічного скла, типами хімічного посуду для аналізу і правилами роботи з аналітичними терезами.
2.Виготовляти стандартні розчини методу нейтралізації.
3.Виконати лабораторні роботи, вказані в цих методичних матеріалах.
4.Оформити та захистити протокол.
5.Відповідати на запитання, запропоновані викладачем, з використанням записів на дошці.
6.Розв'язувати розрахункові задач, запропоновані викладачем.
Експериментальна частина
Завдання 1. Аналітичний посуд, аналітичні терези та методи
Зважування на них
1.1. Аналітичний посуд
Для хімічних аналізів застосовується спеціальний хімічний посуд. До нього висуваються особливі вимоги. Головні з них такі:
1.Посуд повинен бути термічно стабільним, тобто повинен витримувати різні коливання температури і не тріскати при швидкому нагріванні і охолодженні.
2.Посуд повинен бути хімічно стабільним.
1.1.2. Сорти хімічного скла
У Радянському Союзі існували такі марки: Б-2 – містить 73% оксиду силіцію SiO2 і оксиди Аl, Fe, Ca і Na; № 846 - містить менше оксидів Са і Na, а замість них введено 3-4% оксидів бору В2О3 і магнію MgО (так зване борне скло); № 23 - входить біля 3% оксиду бору B2O3 і 7-8% оксиду калію К2О, а вміст SiO2 і Na2O нижчий в порівнянні з Б-2.
Термостійке скло містить 12-13% оксиду бору B2O3 і 80-81% оксиду силіцію SiO2.
Скляний посуд із скла перших двох марок витримує зміну температури від 120-1400С до кімнатної температури. Вироби з термостійкого скла витримують охолодження від 220-2400С до кімнатної t0.
У хімічному аналізі використовують такі скляні вироби: склянки, колби, піпетки, бюретки, пробірки, годинникові скла, лійки, ексикатори.
Вироби із кварцового скла володіють дуже високою термостійкістю (від 8000С до кімнатної температури). Вони стійкі до дії кислот, але малостійкі до лугів. Різновидністю кварцу є агат, з якого виготовляють ступки і пестики (які характеризуються високою твердістю).
Із фарфору виробляють тиглі, чашки, лійки Бюхнера, ступки, шпателі.
1.1.3. Мірний посуд
Мірні колби – це плоскодонні колби з довгою шийкою із міткою ємністю на 25, 50, 100, 250, 500, 1000 і 2000 см3. На колбі вказують ємність і температуру, при якій ця ємність вимірювалась.
Піпетки - довгі тонкі трубки з відтягненим кінцем з однією міткою і градуюванням від 1 до 10 см3. На верхній вузькій частині трубки піпетки нанесена риска, що обмежує певний об’єм.
Бюретки - довгі циліндричні трубки з градуюванням і краном внизу, ємність 10, 25, 50 см3. За їх допомгою вимірюють точний об’єм розчину, що витратили на титрування.
1.2. Аналітичні терези та методи зважування на них
1.2.1. Будова аналітичних терезів
Прийоми точного зважування мають виключне значення не тільки для кількісного аналізу, але й для хімічної науки взагалі.
У кількісному аналізі точність роботи в багатьох випадках визначається точністю, з якою проводиться зважування. Успіх останнього залежить, в більшій мірі, від вимірювального приладу, яким є аналітичні терези.
Головна частина аналітичних терезів – коромисло, яке представляє собою рівноплечий важіль першого роду. Посередині коромисла поміщена агатова або стальна призма, обернена одним із своїх ребер вниз. На кінцях коромисла знаходяться такі ж призми, одне ребро яких направлено вверх. Коромисло опирається ребром центральної призми на стальну або агатову пластину, яка поміщена в верхній частині опорної колонки терезів. На ребра бокових призм підвішені на сережках чашки терезів.
Принцип зважування полягає в тому, що предмет, який зважують кладуть на ліву чашку терезів, а на другу накладають різноважки до тих пір, поки коромисло не прийме положення, яке воно займає без навантаження. Тоді, згідно з правилом моментів сил:
F1l1 = F2l2,
де F1 і F2 – сили, прикладені до обидвох плеч коромисла в точках, на які опираються чашки терезів;
l1 і l2 – довжина плеч, тобто віддалі від цих точок до точки опори коромисла.
1.2.2. Вимоги, які висуваються до аналітичних терез
Терези повинні бути чутливими. Чутливість терезів характеризується величиною відхилення коромисла від початкового положення від мінімального (звичайно 1мг) перевантаження одного із плеч. Терези вважаються тим чутливішими, чим більше відхилення коромисла спостерігається при одному і тому ж перевантаженні.
Терези повинні бути стійкими. Тобто коромисло терезів повинне знаходитися в стані стійкої рівноваги. Стійка рівновага досягається, якщо центр ваги коромисла знаходиться нижче точки опори. Ця умова повинна обов’язково виконуватися для всіх аналітичних терезів, в іншому випадку зважування стає неможливим.
Терези повинні бути правильними. Це значить, що довжина обидвох плеч коромисла повинна бути однакова і ребра всіх трьох призм повинні бути паралельні між собою. Крім того, маси обидвох плеч коромисла разом з відповідними чашками повинні бути однакові.
Набір різноважок є різної маси, які поміщені у спеціальній коробці: 100 г, 50 г, 20 г, 10 г, 5 г, 2 г, 2 г, 1 г, а також 500 мг, 200 мг, 200 мг, 100 мг, 50 мг, 20 мг, 20 мг, 10 мг.
Правила роботи з терезами
1.Терези повинні бути встановлені в окремій ваговій кімнаті.
2.Терези повинні бути захищені від струсів. Для цього їх встановлюють на мармуровій дошці на закріплених в капітальній стіні кронштейнах.
3.Терези повинні бути захищені від різних коливань температури та дії прямих сонячних променів. Бажано, щоб вікна вагової кімнати були обернені на північ.
4.Відлік коливань стрілки необхідно робити при закритих дверцятах терезів. Предмети, які зважують, і різноважки поміщують та знімають з чашок, користуючись боковими дверцятами.
5.Різноважки потрібно розміщувати на чашці терез так, щоб вони знаходились в її центрі.
6.На чашку терезів не можна поміщати гарячих або теплих предметів.
7.Різноважки для попередження від пилу і корозії слід зберігати в закритій коробці. При зважуванні кришку коробки слід відкривати тільки на час, необхідний для виймання різноважок, і потім повернути їх в коробочку.
8.Різноважки слід виймати із коробки і знімати з чашок терезів тільки пінцетом. Брати різноважки руками забороняється.
9.Тим, хто тільки починає зважувати, не потрібно старатися самому ремонтувати терези. При необхідності слід звернутися до лаборанта або керівника заняття.
10.Перед зважуванням необхідно сісти на табуретку проти терезів. Всі рухи повинні бути плавними і без поштовхів.
11.Речовину, яку зважують, не можна класти безпосередньо на чашку терезів. Її потрібно обов’язково помістити в чистий посуд (бюкс, тигель, годинникове скло), летучі речовини можна зважувати тільки в бюксах з накривками. Забороняється зважувати речовину на папірцях і зважуваний предмет ставити безпосередньо на лабораторний стіл.
1.2.4. Техніка зважування
Спочатку слід визначити приблизну масу предмета з точністю до 0,1 г зважуванням на технічних терезах. Нехай виявилось, що маса предмета дорівнює або дещо більша за 8,1 г. Зважуваний предмет кладуть на ліву чашку аналітичних терезів, а на праву ставлять такі різноважки 5 г, 2 г, 1 г і 100 мг, а потім обережно повертають ручку аретиру, не доводячи її до кінця так, щоб можна було тільки встановити, в яку сторону відхиляється стрілка. Нехай стрілка рухається в праву сторону, отже, маса недостатня. Тоді піднімають аретир, знімають різноважку 100 мг і ставлять 200 мг. Якщо тепер при опусканні аретиру стрілка відхиляється вліво, піднімають аретир, знімають 200 мг, ставлять знов 100 мг і додають 50 мг. Таким чином, при зважуванні використовують всі різноважки. Якщо маса виявиться ще більшою, користуються рейтером.
Завдання 2. Приготування стандартних розчинів хлоридної
кислоти та натрію гідроксиду
Приготування робочого титрованого розчину кислоти
2.1.1. Приготування стандартного розчину хлоридної кислоти із концентрованого розчину
Для титрування можна застосовувати хлоридну, сульфатну або нітратну кислоти. Найчастіше користуються хлоридною кислотою. Вона є сильнішою кислотою, ніж сульфатна, і перехід забарвлення індикатора при вживанні хлоридної кислоти більш чіткий.
Майже завжди спочатку готують приблизно 0,1М розчин хлоридної кислоти, а точну її концентрацію потім визначають за певною вихідною сполукою. Робочий титрований розчин кислоти не можна виготовляти безпосереднім розведенням до певного об’єму відміряної або зваженої концентрованої хлоридної кислоти. Остання із густиною 1,19 г/см3 містить приблизно 37% гідрогенхлориду, але визначення концентрації за густиною є неточним.
Найчастіше готують приблизно 0,1М розчин із концентрованої кислоти, а потім визначають молярну концентрацію еквіваленту. Кількість кислоти необхідна для виготовлення 1 дм3 0,1М розчину обчислюють так:
100 г кислоти містить 37 г НСl
х г - 3,65 г (0,1М розчин об’ємом 1 дм3)
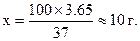
Концентровану кислоту зручніше відміряти, ніж зважувати. Для визначення об’єму знайдену масу ділять на густину:
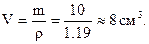
2.1.2. Встановлення молярної концентрації еквіваленту
розчину хлоридної кислоти
Для встановлення молярної концентрації еквіваленту хлоридної кислоти застосовують буру, натрію карбонат, меркурію (ІІ) оксид, натрію оксалат та інші сполуки.
2.1.3. Встановлення концентрації хлоридної кислоти за бурою
При нейтралізації бури Na2B4O7•10H2O хлоридною кислотою відбувається реакція:
Na2B4O7•10H2O + 2НСl = 4Н3BO3 + 2NaCl + 5H2O
Перевага бури полягає у високій молекулярній масі еквіваленту:
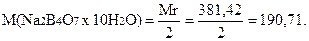
Однак, недоліком бури є те, що при зберіганні вона втрачає частину кристалізаційної води. Тому буру потрібно перекристалізувати. Перекристалізацію бури із води проводять при температурі, яка не перевищує 60оС, оскільки при вищій температурі із розчину виділяється Na2B4O7•5H2O.
Для перекристалізації в 50 см3 води розчиняють при нагріванні 23 г бури (при 60оС в 100 см3 води розчиняється 20 г безводної бури, або біля 46 г Na2B4O7•10H2O). Гарячий розчин фільтрують, збираючи фільтрат у конічну колбу або хімічну склянку.
При охолодженні насиченого розчину із нього викристалізовується Na2B4O7•10H2O. Для одержання дрібнокристалічного осаду розчин, що охолоджується, безперервно помішують скляною паличкою. Дрібний порошок бури відсмоктують на лійці Бюхнера і висушують на повітрі. Висушування вважається закінченим, якщо при перемішуванні порошку скляною паличкою окремі кристалики бури не прилипають до неї. Висушену буру зберігають в склянці з притертим корком.
Для визначення молярної концентрації еквіваленту розчину хлоридної кислоти спочатку готують 0,1н розчин бури. Для цього на аналітичних терезах зважують необхідну масу перекристалізованої і висушеної бури Na2B4O7•10H2O. Звичайно, досить мати 250 см3 розчину, молярна маса еквіваленту бури дорівнює 190,71, тому на 250 см3 розчину потрібно взяти наважку, що дорівнює 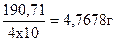 . Наважку переносять в хімічну склянку місткістю 250-300 см3, наливають туди 150-160 см3 гарячої води і перемішують вміст склянки паличкою. Після повного розчинення кристалів бури розчин охолоджують і переливають через лійку в мірну колбу на 250 см3. Склянку, паличку і лійку обмивають декілька разів водою, яку переносять у ту ж мірну колбу. Потім доводять розчин до мітки і добре перемішують вміст колби.
. Наважку переносять в хімічну склянку місткістю 250-300 см3, наливають туди 150-160 см3 гарячої води і перемішують вміст склянки паличкою. Після повного розчинення кристалів бури розчин охолоджують і переливають через лійку в мірну колбу на 250 см3. Склянку, паличку і лійку обмивають декілька разів водою, яку переносять у ту ж мірну колбу. Потім доводять розчин до мітки і добре перемішують вміст колби.
Для встановлення молярної концентрації еквіваленту хлоридної кислоти відбирають в конічну колбу 25 см3 розчину бури і добавляють до розчину 2-3 краплі індикатора (метилового оранжевого). В іншій такій же колбі готують “свідка”. Для цього мірним циліндром вимірюють 40 см3 дистильованої води, додають 1-2 краплі метилового оранжевого і 1 краплю кислоти із бюретки так, щоб появилось слабо-рожеве забарвлення. Після цього встановлюють рівень розчину хлоридної кислоти в бюретці на нуль.
Колбу із розчином натрію тетраборату ставлять під бюретку на аркуш білого паперу і приступають до титрування, повільно доливаючи з бюретки розчин HCl і безперервно перемішуючи рідину круговими рухами колби. Потрібно вловити момент, коли від однієї краплі хлоридної кислоти початково жовтий колір розчину стає блідо-рожевого забарвлення – такого, як у приготованого “свідка”. Добившись зміни забарвлення від однієї краплі титранту, беруть відлік по бюретці і записують його. Якщо нижній край меніску не співпадає із поділкою бюретки, на око відраховують число сотих часток см3.
Концентрацію кислоти вважають встановленою правильно, якщо результати трьох послідовно проведених титрувань показують, що відхилення не перевищують 0,1 см3. Тоді для обчислення концентрації кислоти беруть середнє арифметичне отриманих даних.
Концентрацію розчину хлоридної кислоти розраховують за формулою:
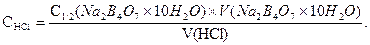
Робочий титрований розчин кислоти зберігають в склянці з притертим або гумовим корком. На склянку наклеюють етикетку, на якій вказують молярну концентрацію еквіваленту кислоти, дату встановлення концентрації, вихідну речовину, за котрою встановлюють концентрацію кислоти, індикатор і прізвище виконавця.
2.1.4. Встановлення молярної концентрації еквіваленту розчину хлоридної кислоти за натрію карбонатом
Часто для встановлення молярної концентрації еквіваленту розчину хлоридної кислоти застосовують препарат безводної соди Na2СО3.
Недоліком соди в порівнянні з бурою є менша молекулярна маса еквіваленту, в зв’язку з чим збільшується відносна похибка зважування. Крім того, безводна сода є гігроскопічною і перед вживанням її необхідно висушувати.
Реакція протікає за рівнянням:
Na2СO3 + 2НСl = 2NaCl + H2СО3.
Із рівняння випливає, що молярна маса еквіваленту Na2СO3 дорівнює половині молекулярної маси: 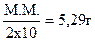 Na2СO3.
Na2СO3.
Наважку переносять у мірну колбу, розчиняють у воді і розчин доводять до мітки. Із рівняння видно, що в точці еквівалентності утворюються натрію хлорид і карбонатна кислота.
Остання до певної міри розпадається на воду і вуглекислий газ, який виділяється із розчину. Однак, значна кількість Н2СO3 залишається в розчині і надає йому слабокислу реакцію. Концентрація карбонатної кислоти в насиченому розчині дорівнює наближено 5•10-2моль/дм3, перша константа дисоціації К = 10-6,5 або рК = 6,5. Із цих даних обчислюють рН в точці еквівалентності за рівнянням рН = 1/2рК - 1/2lgСкисл. = 3,3 + 0,65 = 3,95. Для титрування підходить метиловий оранжевий.
Досить точно можна провести титрування, якщо перед закінченням визначення видалити із розчину СО2 (кип’ятінням). Потім розчин охолоджують і дотитровують до переходу забарвлення індикатора із жовтого до оранжевого.
Для визначення молярної концентрації еквіваленту кислоти відбирають у конічну колбу 25 см3 0,1н розчину Na2СO3, додають 2-3 краплі метилового оранжевого і розчин титрують із бюретки розчином хлоридної кислоти до появи оранжево-червоного забарвлення. Проводять не менше трьох паралельних визначень і для обчислення концентрації беруть середнє арифметичне.
2.1.5. Приготування стандартних розчинів хлоридної кислоти різних концентрацій із концентрованих розчинів
а) Розчин HCl (1 моль/дм3) (М.м. 36,46)
1 cм3 розчину містить 0,03646 г НСl.
Приготування: 85 см3 конц. НСl (густина 1,19 г/см3) поміщують в мірну колбу ємністю 1 дм3, доводять об’єм водою до мітки і добре перемішують.
Встановлення титру: Біля 5 г Na2СO3, прожареного до сталої маси при температурі 280-300oC на пісочній ванні в платиновому тиглі, перемішують час від часу платиновою дротиною. Біля 1 г (точна наважка) Na2СO3, отриманого описаним вище способом, розчиняють в 100 см3 води і титрують виготовленим розчином НСl до появи рожево-оранжевого забарвлення (індикатор – метиловий оранжевий). Молярну концентрацію обчислюють за способом окремих наважок.
б) Розчин НСl (0,5 моль/дм3)
1 см3 розчину містить 0,01823 г НСl.
Приготування: 42 см3 конц. НСl (густина 1,19 г/см3) поміщають в мірну колбу ємністю 1 дм3, доводять об’єм розчину водою до мітки і добре перемішують.
Встановлення титру: Біля 0,6 г (точна наважка) Na2СO3, отриманого описаним вище способом при встановленні титру розчину НСl (1 моль/дм3), розчиняють в 100 см3 води і титрують виготовленим розчином НСl до появи рожево-оранжевого забарвлення (індикатор – метиловий оранжевий).
в) розчин НСl (0,1 моль/дм3)
1 см3 розчину містить 0,003646 г НСl.
Приготування: 8,5 см3 конц. НСІ (густина 1,19 г/см3) поміщають у мірну колбу ємністю 1 дм3, доводять об’єм розчину водою до мітки і добре перемішують.
Встановлення титру: Біля 0,15 г (точна наважка) Na2СO3, отриманого, як описано при встановленні титру розчину НСl (1моль/дм3), розчиняють у 50 см3 води і титрують виготовленим розчином НСl до появи рожево-оранжевого кольору (індикатор – метиловий оранжевий).
2.1.6. Приготування розчину хлоридної кислоти із фіксаналу
Для приготування розчину із фіксаналу, ампулу промивають зверху теплою водою, щоб змити етикетку і споліскують її водою.
У мірну колбу поміщують лійку, в неї встановлюють скляний цвяшок таким чином, щоб довгий кінець увійшов в трубку лійки, а другий короткий гострий кінець цвяшка був направлений вверх. Дно вимитої ампули пробивають об гострий кінець цвяшка в лійці. Другим цвяшком пробивають верхнє заглиблення в ампулі. Сильним струменем води із промивалки повністю виливають вміст ампули в лійку. Потім добре промивають поверхню ампули, лійку з цвяшком і перемішують вміст колби. Після цього доводять рівень розчину водою до мітки. Колбу закривають корком і добре перемішують розчин, перевертаючи колбу. Приготовлений розчин переносять в хімічну посудину ємністю 1дм3.
