Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов - от морфологически самых простых до наиболее сложных - выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели - сохранению постоянства внутренней среды.
Гомеостаз - относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими. Учение о гомеостазе - это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни.
Способность раствора поддерживать определенное значение рН называется буферным действием.
Буферным действием обладают:
1. Система слабая кислота – ее соль с сильным основанием, а также сочетание кислой и средней солей слабых кислот или двух кислых солей;
2. Система слабое основание – его соль с сильной кислотой;
3. Ионы и молекулы амфолитов – аминокислотные и белковые системы.
Основная функция буферных систем - предотвращение значительных сдвигов рН путём взаимодействия буфера, как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.
4.6. Буферные системы: определение, классификация
Слабые кислоты и основания, в отличие от сильных (диссоциирующих практически полностью), распадаются на ионы в очень небольшой степени. Поэтому, например, в растворе слабой кислоты, можно выделить:
· общую кислотность – концентрация растворённой кислоты, которую можно определить титрованием раствором щёлочи до полной нейтрализации;
· активную кислотность – концентрации свободных протонов в растворе;
· потенциальную или резервную кислотность, заключённоую в недиссоциированных молекулах кислоты.
Аналогично, слабые основания обладают тремя видами щёлочности.
Кроме того, слабые электролиты подчиняются закону разведения Оствальда, согласно которому степень диссоциации слабого электролита обратно пропорциональна корню квадратному из его концентрации:
α = 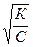 ,
,
где К – константа диссоциации, С – молярная концентрация;
или прямо пропорциональна корню квадратному из его разведения:
α = 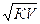 , где V – разведение
, где V – разведение
Как вы помните из курса средней школы, реакция среды в растворах солей определяется их способностью к гидролизу. Так, соли, образованные слабой кислотой и сильным основанием, подвергаясь гидролизу по аниону, смещают равновесие диссоциации воды в сторону образования гидроксид-анионов. Среда становится щелочной. Например:
СН3СОО- + Na+ + Н2О → СН3СООН + Na+ + ОН-
Соли, образованные слабым основанием и сильной кислотой, подвергаясь гидролизу по катиону, смешает равновесие диссоциации воды в сторону образования протонов.
Например: NН4+ + Сl- + Н2О → NН4ОН + H+ + Cl-
Буферные системы (БС) – водные растворы, препятствующие изменению рН при добавлении небольших количеств сильных кислот, оснований, а также при разбавлении и концентрировании.
Состав любой БС включает в себя 2 компонента в следующих вариантах:
а) слабая кислота и её соль, образованная сильным основанием;
б) слабое основание и его соль, образованная сильной кислотой.
Пример БС первого типа – ацетатный буфер:
СН3СООН/СН3СОО-+Na+
где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH).
Пример БС второго типа – аммиачный буфер:
NH4OH/NH4+ + Cl-
где NH4OH – слабое основание, NH4+ + Cl- - его соль, образованная сильной кислотой (HCl).
Важнейшим компонентом БС является именно слабый электролит. Он обеспечивает резервную кислотность или основность.
Классификация кислотно-основных буферных систем:
Буферные системы могут быть четырех типов:
1. Слабая кислота и ее анион А- /НА:
ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН = 3,8-5,8.
Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия – рН = 5,4-7,4.
2. Слабое основание и его катион В/ВН+:
аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl,
область ее действия – рН = 8,2-10, 2.
3. Анионы кислой и средней соли или двух кислых солей:
карбонатная буферная система СО32-/НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН = 9,3-11,3.
фосфатная буферная система НРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН = 6,2-8,2.
Эти солевые буферные системы можно отнести к 1-му типу, т.к. одна из солей этих буферных систем выполняет функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой.
4. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму «белок-кислота» или соответственно в форму «белок-основание».
