Ацетилсалициловая кислота (аспирин)
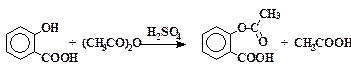
В небольшую коническую колбу помещают 2 г предварительно высушенной при 100 °С салициловой кислоты и 2,8 мл уксусного ангидрида. Добавляют 2 – 3 капли концентрированной серной кислоты и хорошо перемешивают содержимое колбы. Не прекращая размешивания, нагревают смесь на водяной бане при 60 °С в течение 15 мин, а затем дают ей охладиться до комнатной температуры.
Добавляют в колбу 30 мл воды, хорошо перемешивают и отфильтровывают осадок на воронке Бюхнера. Неочищенную ацетилсалициловую кислоту перекристаллизовывают из смеси равных объемов уксусной кислоты и воды, отфильтровывают, промывают на фильтре ледяной водой и затем толуолом. Полученный таким образом аспирин сушат при 40 – 60 °С до исчезновения запаха уксусной кислоты. Выход 95 %. Тпл 144 °С
Пояснения к синтезу
Ацилированию, т.е. замещению подвижных атомов водорода на остатки кислот – ацилы – могут подвергаться амины, фенолы, спирты и другие соединения. При синтезе аспирина водород фенольного гидроксила в салициловой кислоте замещается на остаток уксусной кислоты – ацетил (СН3СО-). Механизм реакции может быть представлен следующим образом:
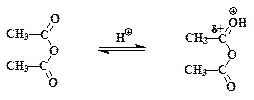
уксусный ангидрид I:протонированый уксусный ангидрид
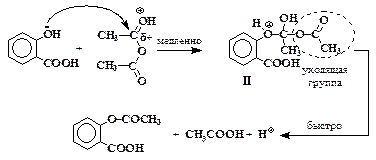
Это пример нуклеофильного замещения у карбонильного атома углерода в уксусном ангидриде. Из-за электроноакцепторного влияния орто-карбоксильной группы в салициловой кислоте основные (и нуклеофильные) свойства фенольного гидроксила ослаблены. Это вызывает необходимость добавлять в смесь кислотный катализатор (конц. Н2SО4). Сам фенол ацилируется уксусным ангидридом в отсутствии кислоты. Протонирование карбонильного кислорода приводит к катиону I, в котором электрофильность углерода сильно повышена. Это облегчает нуклеофильную атаку и образование промежуточного соединения II, в котором карбонильный углерод переходит из sр2- в sр3- состояние.
При перекристаллизации продукта из разбавленной уксусной кислоты не следует кипятить раствор дольше, чем требуется для растворения ацетилсалициловой кислоты во избежание ее гидролитического разложения. Перекристаллизованный продукт отфильтровывают и осадок промывают сначала небольшим количеством ледяной воды, а затем холодным толуолом.
Чистая ацетилсалициловая кислота имеет температуру плавления 144 °С. Однако при нагревании она разлагается, поэтому ее истинную температуру плавления определить трудно. Обычно получается препарат, плавящийся в интервале 129 – 133 °С.
Контрольные вопросы
1. Почему при взаимодействии салициловой кислоты и уксусного ангидрида в качестве нуклеофильного центра выступает кислород фенольной, а не карбоксильной группы ОН?
2. Почему салициловая кислота ацилируется труднее фенола?
3. Объясните, почему серная кислота ускоряет реакцию ацилирования салициловой кислоты?
4. Напишите реакцию гидролиза аспирина. Как эта реакция может влиять на результат определения температуры плавления полученного препарата? Что следует предпринять для того, чтобы температура плавления препарата была как можно ближе к истинной температуре плавления ацетилсалициловой кислоты (135 °С)?
5. Напишите схему механизма гидролиза ацетилсалициловой кислоты, проходящего в кислой среде. Будет ли аспирин гидролизоваться в щелочной среде?
6. С помощью какой цветной реакции можно обнаружить примесь салициловой кислоты в долго хранившемся аспирине? Для ответа на этот вопрос необходимо прочитать в учебнике о цветных реакциях фенолов [1].
7. Какие предосторожности нужно соблюдать при синтезе ацетилсалициловой кислоты?
2.1.6. н-Бутилацетат
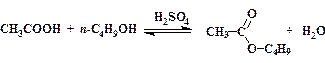
В круглодонную колбу емкостью 100 мл, снабженную ловушкой для отделения воды и обратным холодильником (рис. 14), помещают 10 мл ледяной уксусной кислоты, 12 мл н-бутилового спирта, 5 капель конц. серной кислоты и несколько небольших осколков фарфора, которые будут служить в качестве “кипелок”. Нагревают колбу на песчаной бане. Жидкость должна кипеть достаточно интенсивно, однако, обратный холодильник не должен “захлебываться”.
Вода, образующаяся по реакции, улетает из реакционной колбы вместе с парами спирта и сложного эфира. Смесь паров конденсируется в обратном холодильнике, конденсат попадает из него в ловушку и в ней расслаивается. Верхний органический слой, в котором содержатся образовавшийся сложный эфир и бутиловый спирт, возвращается (перетекает) в колбу, а нижний слой воды постепенной увеличивается.
| После того, как количество воды в ловушке перестанет увеличиваться, колбе дают охладиться и реакционную смесь вместе с содержимым ловушки переносят в делительную воронку. Нижний слой отделяют, а верхний промывают вначале водой, затем 5 % раствором соды и вновь водой. Сложные эфиры при энергичном встряхивании с промывными жидкостями дают стойкие эмульсии; во избежание этого делительную воронку целесообразно не встряхивать, а совершать ею движение, подобное “восьмерке”. Отмытый бутилацетат обезвоживают прокаленным сульфатом натрия не менее 6 час, затем подвергают дробной перегонке, собирая фракцию 124 – 126 °С. Выход 80 %. Ткип 126 °С По этой методике могут быть получены: из изобутилового спирта – изобутилацетат, Ткип 118 °С, из изоамилового спирта – изоамилацетат, Ткип 142 °С. | 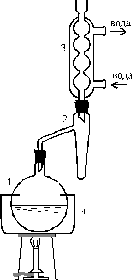 Рис. 14. Установка для проведения реакций с азеотропной отгонкой воды: 1 – реакционная колба, 2 – ловушка для отделения воды, 3 – обратный холодильник, 4 – воздушная или песчаная баня Рис. 14. Установка для проведения реакций с азеотропной отгонкой воды: 1 – реакционная колба, 2 – ловушка для отделения воды, 3 – обратный холодильник, 4 – воздушная или песчаная баня |
Пояснения к синтезу
Реакция этерификации – обратимый процесс, поэтому для того, чтобы добиться более полного превращения карбоновой кислоты в сложный эфир, из реакционной смеси удаляют образующуюся воду. Для этого используют способность воды отгоняться из реакционной массы в виде азеотропной смеси со спиртом и сложным эфиром.
Азеотропная смесь веществ кипит и перегоняется как одно индивидуальное соединение с определенной температурой кипения; ее невозможно разделить путем перегонки. Примером азеотропной смеси является 96 % этиловый спирт. Этот азеотроп имеет температуру кипения 78,17 °С в отличие от Ткип чистого этанола 78,3° С. Для получения 100 % (“абсолютного”) этилового спирта приходится применять специальные методы: химически связывать воду с помощью безводных солей (СuSО4), оксида кальция, металлического магния. Можно также отгонять воду в виде тройного азеотропа бензол-этанол-вода, добавляя к 96 % этанолу бензол с последующей перегонкой.
Азеотропные смеси могут иметь меньшие или большие температуры кипения по сравнению с Ткип составляющих их компонентов. Для отделения воды используют смеси с минимальными температурами кипения. Не всякая пара летучих веществ образует азеотропную смесь. Например, уксусная кислота не образует азеотропа с водой. В тех случаях, когда ни реагенты, ни продукт реакции не образует азеотропных смесей с водой или когда в азеотропе соотношение вода-органическое соединение слишком мало (как, например, в случае этилового спирта), в реакционную массу добавляют растворитель, способный образовывать азеотропную смесь с водой. Так, при получении по вышеописанной методике этил- или пропилацетата в колбу вносят 35 – 40 мл хлороформа или четыреххлористого углерода.
Азеотропная смесь вода-бутиловый спирт перегоняется при 92,7 °С (сравните с температурами кипения н-бутанола, воды и уксусной кислоты). Она содержит 42,5 % Н2О и 57,5 % спирта. Азеотроп вода-н-бутилацетат, содержащий 28,7 % Н2О и 71,3 % сложного эфира, кипит при 90,2 °С. В присутствии всех трех компонентов перегоняется и тройная азеотропная смесь вода-бутанол-бутилацетат.
2.2. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ
В АРОМАТИЧЕСКОМ РЯДУ
