Окислительно-восстановительные реакции. Базовый уровень сложности
Базовый уровень сложности
1.Окислительно-восстановительной является реакция, уравнение которой
| 1) | H2S + 2KOH = K2S + 2H2O |
| 2) | FeО+ 2HCl = FeCl2 + H2O |
| 3) | SO3 + СaO = CaSO4 |
| 4) | FeО + CO = Fe + CO2 |
2.Процесс окисления отражен схемой
| 1) | SO3 → SO 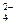 | 3) | S → SO2 |
| 2) | SO 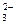 → SO2 → SO2 | 4) | SO 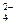 → S → S |
3.Процесс окисления отражен схемой
| 1) | NO2 → NO  | 3) | NO2 → NO 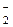 |
| 2) | NO  → N2 → N2 | 4) | N2O5 → NO  |
4.Процесс восстановления отражен схемой
| 1) | NO 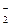 → NO → NO  | 3) | NO2 → NO  |
| 2) | NO  → N2О → N2О | 4) | N2O3 → NO 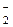 |
5.Процесс восстановления отражен схемой
| 1) | СO2 → СO 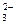 | 3) | СO2 → СО |
| 2) | С → СO2 | 4) | СО → СО2 |
6.Pеакции, уравнение которой
SO2 + Cl2 +2H2O = H2SO4 + 2HCl,
соответствует схема изменения степени окисления серы
| 1) | S+2 → S+4 | 2) | S+4 → S+6 | 3) | S+4 → S+2 | 4) | S-2 → S+4 |
7.Процесс восстановления отражен схемой
| 1) | Сr2O3 → СrO 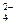 | 3) | Сr2O 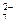 → СrO → СrO 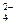 |
| 2) | СrO 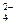 → Сr2O → Сr2O 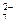 | 4) | Сr2O 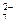 → Сr3+ → Сr3+ |
8.Схеме превращений
NO  → NO2 → NO
→ NO2 → NO 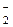 → N2O
→ N2O
соответствует последовательность изменения степени окисления азота
| 1) | N+3 → N+2 → N+3 → N+1 | 3) | N+5 → N+3 → N+4 → N+2 |
| 2) | N+5 → N+4 → N+3 → N+1 | 4) | N+5 → N+3 → N+4 → N+1 |
9.Схеме превращений
SO 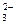 → SO2 → SO
→ SO2 → SO 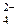 → H2S
→ H2S
соответствует последовательность изменения степени окисления серы
| 1) | S+4 → S+4 → S+6 → S+2 | 3) | S+4 → S+4 → S+6 → S-2 |
| 2) | S+6 → S+4 → S+6 → S-2 | 4) | S+6 → S+4 → S+4 → S+2 |
10.Схеме превращений
SO3 → SO 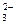 → SO
→ SO 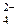 → H2S
→ H2S
соответствует последовательность изменения степени окисления серы
| 1) | S+4 → S+4 → S+6 → S+2 | 3) | S+6 → S+4 → S+4 → S+2 |
| 2) | S+6 → S+4 → S+6 → S-2 | 4) | S+4 → S+4 → S+6 → S-2 |
11.Последовательности изменения степени окисления азота
N+4 → N+5 → N0 →N-3
соответствует схема превращений
| 1) | NO2 → NO  → N2 → NH3 → N2 → NH3 |
| 2) | NO2 → NO  → N2 → N2О3 → N2 → N2О3 |
| 3) | NO 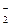 → NO → NO  → N2 → NH3 → N2 → NH3 |
| 4) | NO 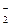 → NO → NO  → N2 → N2О3 → N2 → N2О3 |
12.Последовательности изменения степени окисления серы
S+4 → S+4 → S-2 → S+6
соответствует схема превращений
| 1) | SO 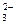 → SO3 → SO2 → SO → SO3 → SO2 → SO 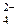 |
| 2) | SO2 → SO 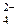 → H2S → SO3 → H2S → SO3 |
| 3) | SO 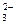 → SO → SO 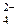 → H2S → SO3 → H2S → SO3 |
| 4) | SO2 → SO 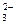 → H2S → SO → H2S → SO 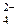 |
13.В схеме превращений
SO2  SO
SO 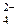
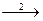 S
S 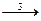 SO
SO 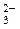
 H2S
H2S
сера проявляет восстановительные свойства на стадиях
| 1) | 1 и 2 | 2) | 1 и 3 | 3) | 3 и 4 | 4) | 2 и 4 |
14.В схеме превращений
NO2  NO
NO 
 N2
N2  NH3
NH3  NO
NO
азот проявляет окислительные свойства на стадиях
| 1) | 1 и 2 | 2) | 1 и 3 | 3) | 2 и 3 | 4) | 3 и 4 |
15.В схеме превращений
MnO2  Mn2+
Mn2+  MnO2
MnO2  MnO
MnO 
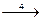 MnO
MnO 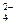
марганец проявляет восстановительные свойства на стадиях
| 1) | 1 и 4 | 2) | 2 и 3 | 3) | 2 и 4 | 4) | 3 и 4 |
16.В схеме превращений
Cr(OH)3 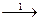 CrO
CrO 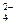
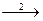 Cr2O
Cr2O 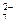
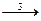 Cr3+
Cr3+ 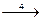 Cr
Cr
хром проявляет окислительные свойства на стадиях
| 1) | 1 и 3 | 2) | 2 и 3 | 3) | 2 и 4 | 4) | 3 и 4 |
17.Сера проявляет окислительные свойства при взаимодействии с
| 1) | HNO3 | 2) | O2 | 3) | Fe | 4) | Cl2 |
18.Углерод проявляет восстановительные свойства при взаимодействии
| 1) | Са | 2) | H2 | 3) | Al | 4) | FeO |
19.Фосфор проявляет окислительные свойства при взаимодействии с
| 1) | O2 | 2) | HNO3 | 3) | Mg | 4) | Cl2 |
20.Только окислителем за счет атомов марганца может быть соединение, формула которого
| 1) | MnO2 | 2) | K2MnO4 | 3) | KMnO4 | 4) | Mn2O3 |
21.Только восстановителем за счет атомов азота может быть соединение, формула которого
| 1) | Ca3N2 | 2) | KNO2 | 3) | KNO3 | 4) | N2O3 |
22.Только восстановителем может быть
| 1) | C | 2) | N2 | 3) | Al | 4) | Si |
23.Только окислительные свойства за счет атомов серы проявляет
| 1) | сера | 3) | сероводород |
| 2) | сульфат натрия | 4) | сернистый газ |
24.Только восстановительные свойства за счет атомов серы проявляет
| 1) | сернистая кислота | 3) | серная кислота |
| 2) | сероводород | 4) | сернистый газ |
25.Окислительно-восстановительную двойственность за счет атомов азота может проявлять
| 1) | NH4Cl | 2) | KNO3 | 3) | N2O5 | 4) | НNO2 |
26.Окислительно-восстановительную двойственность за счет атомов серы может проявлять
| 1) | SO3 | 2) | H2SO3 | 3) | K2S | 4) | K2SO4 |
27.Окислительно-восстановительную двойственность за счет атомов марганца может проявлять
| 1) | КMnO4 | 2) | Mn2O7 | 3) | MnO2 | 4) | Mn |
28.Окислительно-восстановительную двойственность за счет атомов хрома может проявлять
| 1) | K2CrO4 | 2) | K2Cr2O7 | 3) | Cr(OH)3 | 4) | CrO3 |
29.В реакции оксида железа(III) c оксидом углерода(II) окислительные свойства проявляет
| 1) | Fe+3 | 2) | C+2 | 3) | O-2 | 4) | Fe |
30.Восстановительные свойства углерод проявляет в реакции, уравнение которой
| 1) | Ca + 2C = CaC2 | 3) | С + 2Н2 = СН4 |
| 2) | 2С + SiO2 = Si + 2CO | 4) | 3С + 4Al = Al4C3 |
31.Окислительно-восстановительную двойственность сера проявляет в реакции, уравнение которой
| 1) | S + 6HNO3 = H2SO4 + 6NO2 + 2H2O |
| 2) | 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O |
| 3) | 2S + C = CS2 |
| 4) | S + 3F2 = SF6 |
32.Окислительно-восстановительную двойственность хлор проявляет в реакции, уравнение которой
| 1) | Cl2 + 2KBr = 2KCl + Br2 |
| 2) | Cl2 + CH4 = CH3Cl + HCl |
| 3) | Cl2 + H2O = HCl + HClO |
| 4) | 3Cl2 + 2Fe = 2FeCl3 |
33.Окислительные свойства СО2 проявляет в реакции, уравнение которой
| 1) | СO2 + 2NaOH = Na2CO3 + H2O |
| 2) | СO2 + 2Mg = C + 2MgO |
| 3) | СO2 + MgO = MgCO3 |
| 4) | СO2 + H2O + CaCO3 = Ca(HCO3)2 |
34.Окислительные свойства SО2 проявляет в реакции, уравнение которой
| 1) | SO2 + 2KOH = K2SO3 + H2O |
| 2) | SO2 + NO2 = SO3 + NO |
| 3) | SO2 + C = S + CO2 |
| 4) | SO2 + CaO = CaSO3 |
35.Восстановительные свойства SО2 проявляет в реакции, уравнение которой
| 1) | SO2 + CaO = CaSO3 |
| 2) | SO2 + NO2 = SO3 + NO |
| 3) | SO2 + 2H2S = 3S + 2H2O |
| 4) | SO2 + 2NaOH = Na2SO3 + H2O |
36.В реакции цинка с концентрированной серной кислотой окислителем и восстановителем соответственно являются
| 1) | H+ и Zn0 | 2) | SO 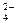 и Zn0 и Zn0 | 3) | Zn0 и SO 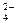 | 4) | Zn0 и H+ |
37.В реакции цинка с концентрированной азотной кислотой окислителем и восстановителем соответственно являются
| 1) | Н+ и Zn0 | 2) | Zn0 и NO 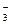 | 3) | NO 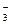 и Zn0 и Zn0 | 4) | Zn0 и H+ |
38.В реакции цинка с разбавленной серной кислотой окислителем и восстановителем соответственно являются
| 1) | Zn0 и SO 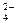 | 2) | H+ и Zn0 | 3) | SO 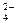 и Zn0 и Zn0 | 4) | Zn0 и Н+ |
39.Оксид железа(II) проявляет восстановительные свойства при взаимодействии с
| 1) | соляной кислотой |
| 2) | разбавленной серной кислотой |
| 3) | концентрированной азотной кислотой |
| 4) | оксидом углерода(II) |
40.Оксид серы(IV) проявляет восстановительные свойства при взаимодействии с
| 1) | гидроксидом натрия |
| 2) | оксидом кальция |
| 3) | сероводородом |
| 4) | хлором |
41.Схеме превращения Cr+2 → Cr+3 соответствует реакция, уравнение которой
| 1) | CrCl2 + 2NaOH = Cr(OH)2 + 2 NaOH |
| 2) | 4CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O |
| 3) | CrO + H2SO4 = CrSO4 + H2O |
| 4) | CrО + 2HCl = CrCl2 + H2O |
42.Схеме превращения S+6 → S+4 соответствует реакция, уравнение которой
| 1) | H2SO4 + 2NaOH = Na2SO4 + 2 H2O |
| 2) | 5H2SO4(конц) + 4Zn = 4ZnSO4 + H2S + 4H2O |
| 3) | 2H2SO4(конц) + Cu = CuSO4 + SO2 + 2H2O |
| 4) | Na2SO3 + 2HCl = 2NaCl + SO2 + H2O |
43.Схеме превращения N+5 → N+4 соответствует реакция, уравнение которой
| 1) | HNO3 + NaOH = NaNO3 + H2O |
| 2) | 8HNO3(разб) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O |
| 3) | 2KNO3 = 2KNO2 + O2 |
| 4) | 2HNO3(конц) + Ag = AgNO3 + NO2 + H2O |
44.Схеме превращения Fe+3 → Fe+2 соответствует реакция, уравнение которой
| 1) | FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl |
| 2) | 2FeCl3 + H2S = 2FeCl2 + S + 2HCl |
| 3) | 2Fe(OH)3 = Fe2O3 + 3H2O |
| 4) | Fe3O4 + 4H2 = 3Fe + 4H2O |
45.Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
| 1) | SO2 + H2S → S + H2O |
| 2) | S + H2SO4 → SO2 + H2O |
| 3) | S + H2SO4 → H2S + H2O |
| 4) | H2SO4 + H2S → S + H2O |
46.Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
| 1) | HNO2 + KMnO4 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O |
| 2) | KMnO4 + NaNO3 + H2SO4 → MnSO4 + NaNO2 + K2SO4 + H2O |
| 3) | KMnO4 + SO2 + H2O → MnSO4 + H2SO4 + K2SO4 |
| 4) | KMnO4 + HBr → Br2 + MnBr2 + KBr + H2O |
47.Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
| 1) | SO2 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O |
| 2) | NaI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O |
| 3) | K2Cr2O7 + Fe + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O |
| 4) | KI + K2Cr2O7 + H2SO4 → I2 + К2CrO4 + K2SO4 + H2O |
