Строение мицеллы лиофобных золей
Элементарная коллоидная частица – мицелла – содержит нерастворимое в данной дисперсионной среде ядро, состоящее из диспергированного твердого вещества (агрегата) с адсорбированными ионами (потенциалопределяющими ионами – ПОИ). По правилу Панета – Фаянса «на поверхности твердого вещества адсорбируются ионы, способные достраивать его кристаллическую решетку, т.е. ионы, имеющие общую атомную группировку с агрегатом». Эти ионы и придают поверхности ядра электрический заряд. После возникновения заряда ядро притягивает из раствора ионы с противоположным знаком (противоионы), образуется двойной электрический слой. Часть противоионов прочно притягивается к ядру, образуя адсорбционный слой противоионов. Ядро вместе с адсорбционным слоем называется частицей или гранулой. Гранула характеризуется двойным электрическим слоем, который образуется из потенциалопределяющих ионов и противоионов. Противоионы,, которые находятся вне гранулы, образуют диффузный слой противоионов.
Схема строения мицеллы (рис. 6.7).
Пример: золь иодида серебра, полученного по реакции взаимодействия АgNO3 и KI при избытке KI.
АgNO3 + KI → АgI- + КNO3

Рис. 6.7. Строение мицеллы:
1 – агрегат; 2 – потенциалопределяющие ионы; 3 – ядро; 4 – противоины адсорбционного слоя; 5 – противоионы диффузного слоя; 6 – гранула
6.6. Свойства лиофобных коллоидных растворов: молекулярно-кинетические, оптические, диализ, электродиализ
Основные свойства лиофобных золей связаны с их ультрамик-рогетерогенностью, т.е. мельчайшими размерами частиц дисперсной фазы, и огромной суммарной поверхностью раздела между дисперсной фазой и дисперсионной средой.
Молекулярно-кинетические свойства (МКС). К ним относятся свойства, связанные с тепловым движением частиц: броуновское движение, диффузия, осмос. Эти свойства зависят от размеров и массы частиц дисперсной фазы (броуновское движение и диффузия), а также от числа частиц в единице объема системы (осмотическое давление). Так как размеры коллоидных частиц значительно больше размеров отдельных ионов и молекул, то, при одинаковой массовой концентрации, число коллоидных частиц в единице объема коллоидного раствора будет гораздо меньше, чем число молекул или ионов в единице объема истинных растворов низкомолекулярных веществ. Этим объясняется тот факт, что МКС в коллоидных растворах выражены менее интенсивно, чем в истинных: скорость диффузии коллоидных частиц очень мала, осмотическое давление коллоидных растворов низкое. Так, осмотическое давление 1% истинного раствора сахара составляет 79,5 кПа, а 1% коллоидного раствора сульфида мышьяка (3) As2S3 - всего 3,4×10-3кПа.
Оптические свойства. Специфическим свойством коллоидных растворов является их способность рассеивать свет. Это обусловлено гетерогенностью коллоидных систем и размерами коллоидных частиц.
Грубодисперсные системы, размеры частиц в которых (r > > 10-6 м) значительно превышают длины волн видимого света (𝝀 = (3,6-7,6)×10-7 м), отражают свет и поэтому выглядят мутными. В истинных растворах низкомолекулярных веществ молекулы и ионы имеют размеры 10-10-10-9 м, что значительно меньше длин волн видимого света, поэтому они пропускают свет и являются прозрачными.
Если размеры коллоидных частиц (r = 10-7-10-6 м) соизмеримы с длинами волн видимого света, то такие коллоидные растворы рассеивают свет вследствие явления дифракции. Рассеяние света можно наблюдать при боковом освещении коллоидного раствора: в случае точечного источника света - в виде светящегося конуса (эффект Тиндаля), а при обычном боковом освещении - в виде голубоватой опалесценции раствора. Согласно закону Рэлея интенсивность рассеянного света I зависит от интенсивности I0 и длины волны 𝝀 падающего света, объема частиц V и их концентрации с:
I = IoK 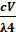
где К - константа, зависящая от соотношения коэффициентов преломления дисперсионной среды и дисперсной фазы.
Из этого выражения следует, что чем меньше длина волны падающего излучения, тем больше будет рассеяние. Этим объясняется голубоватая опалесценция при боковом освещении коллоидных растворов. Красный свет имеет наибольшую длину волны (620-760 нм) в видимой части спектра и рассеивается в меньшей степени. Поэтому запрещающие сигналы имеют красный цвет. Рассеянный солнечный свет, который образуется из-за аэрозольных частиц в атмосфере, имеет голубую окраску и создает голубой цвет неба. На способности золей рассеивать свет основаны такие методы анализа, как нефелометрия и ультрамикроскопия, которые используются для определения концентрации частиц и их размеров в гетерогенных биологических средах.
Диализ. Биологические жидкости, как правило, содержат одновременно вещества в коллоидном состоянии и в виде отдельных молекул и ионов. Очистка коллоидных растворов от истинно растворенных веществ основывается на том, что относительно крупные коллоидные частицы, в отличие от молекул и ионов, не проникают сквозь поры животных и растительных мембран. На практике в качестве мембраны используется пленка из коллодия или целлофана (производные целлюлозы), а также кишечная ткань.
Диализ - процесс очистки коллоидных растворов от ионов и молекул низкомолекулярных примесей в результате их диффузии в чистый растворитель сквозь полупроницаемую мембрану.
Простейший способ диализа заключается в том, что коллоидный раствор помещают во внутренний сосуд, дно или стенки которого представляют собой мембрану с избирательной проницаемостью, погруженный во внешний сосуд с чистым растворителем (обычно вода). В результате диффузии молекулы и ионы, способные проникать сквозь поры мембраны, переходят в наружный сосуд. В обычных условиях диализ протекает очень медленно. Для ускорения процесса необходимо увеличить градиент концентраций растворенных веществ по обе стороны мембраны. Это легко осуществить периодической или непрерывной сменой растворителя в наружном сосуде (рис. 6.8 а).
Для ускорения очистки коллоидных растворов от ионов растворенных электролитов используют также метод электродиализа. В этом случае во внешний сосуд помещают электроды и подают постоянный электрический ток (рис. 6.8 б).
Электродиализ - это диализ в условиях наложения постоянного электрического поля, под действием которого катионы и анионы приобретают направленное движение к электродам. Электродиализ особенно эффективен при малых концентрациях удаляемого электролита, когда градиент концентраций невелик.
 |
Рис. 6.8. Схемы диализатора (а) и электродиализатора (б):
1 - диализуемый коллоидный раствор; 2 - мембрана; 3 - подача растворителя; 4 - мешалка; 5 - электроды
В биологических жидкостях количественное определение низкомолекулярных веществ часто проводят методом компенсационного диализа, или вивидиализа. В этом случае биологическая жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества. Так, содержание сахара в сыворотке крови определяется путем диализа сыворотки по сравнению с изотоническим раствором, к которому добавляют различные количества сахара. Концентрация сахара во внешнем растворе не изменяется лишь в том случае, когда она равна концентрации сахара в анализируемой сыворотке. Таким образом было выявлено наличие глюкозы и мочевины в крови.
По принципу диализа работает аппарат «искусственная почка» (АИП), применяемый при острой почечной недостаточности, которая может наступить в результате отравления сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах и т.п. АИП подключается к системе кровообращения больного, и кровь протекает через систему, снабженную мембранами с избирательной проницаемостью, которые снаружи омываются физиологическим раствором. При этом кровь в процессе диализа очищается от вредных примесей, после чего поступает обратно в организм.
6.7. Устойчивость коллоидных растворов: седиментационная, агрегативная. Факторы, влияющие на устойчивость лиозолей
Биологические жидкости живого организма, такие как кровь, плазма, лимфа, спинномозговая жидкость, моча, представляют собой коллоидные системы. О состоянии организма можно судить по многим показателям этих жидкостей, и прежде всего крови. Наличие патологических процессов сопровождается изменением количества форменных элементов крови (эритроцитов, лейкоцитов и др.), скорости оседания эритроцитов (СОЭ), свертываемости крови и др. Все эти свойства связаны с устойчивостью биологических жидкостей, поэтому изучение устойчивости коллоидных растворов и факторов, влияющих на нее, очень важно для медиков и биологов.
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц дисперсной фазы во всем объеме дисперсионной среды.
В дисперсных системах различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными cвои размеры.
Грубодисперсные системы гетерогенны и неустойчивы. Они самопроизвольно расслаиваются на дисперсную фазу и дисперсионную среду, так как относительно крупные частицы дисперсной фазы под действием сил тяжести оседают (седиментируют).
Истинные растворы гомогенны и неограниченно устойчивы, поскольку в них не происходит самопроизвольное выделение растворенного вещества из системы.
Коллоидные растворы относятся к ультрамикрогетерогенным системам и по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено малыми размерами частиц и их интенсивным броуновским движением.
Агрегативная устойчивость коллоидных растворов с ионным стабилизатором обусловлена наличием на поверхности частиц «рыхлой» ионной атмосферы из гидратированных противоионов, которая увеличивает сродство коллоидных частиц к дисперсной среде и препятствует их слипанию (коагуляции). Ее можно рассматривать как результат взаимодействия двух противоположно направленных сил, которые одновременно действуют на сближающиеся коллоидные частицы: вандерваальсовых сил межмолекулярного притяжения и электростатических сил отталкивания, которые возникают между одноименно заряженными частицами. При сближении коллоидных частиц на расстояние 10-9-10-6 м в области перекрывания их ионных атмосфер, в тонких жидких пленках, разделяющих две твердые поверхности (поверхности ядер), возникает так называемое расклинивающее давление. Оно складывается из трех основных составляющих:
· электростатическое отталкивание одноименно заряженных частиц за счет большого скопления противоионов в области контакта ионных атмосфер;
· расклинивание за счет упругих свойств гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;
· расклинивание за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т. е. в область большого скопления противоионов.
 |
Рис. 6.9. Схема агрегативной устойчивости мицелл коллоидных растворов
В коллоидных растворах с ионным стабилизатором главной составляющей расклинивающего давления является электростатическое отталкивание одноименно заряженных частиц. Величина расклинивающего давления зависит от заряда твердой фазы, т.е. от значения межфазного потенциала Фмф, а также от толщины ионной атмосферы, главным образом ее диффузного слоя, т. е. от значения ζ-потенциала (рис. 6.9). Чем выше заряд твердой фазы, чем больше толщина диффузного слоя и больше значение ζ-потенциала, тем больше расклинивающее давление между частицами и выше агрегативная устойчивость коллоидного раствора. Когда диффузный слой мицеллы тонкий и ζ-потенциал меньше 30 мВ, упругие свойства диффузного слоя невелики, и поэтому при столкновении мицелл происходит перекрывание этих слоев, что приводит к преобладанию сил притяжения и потере агрегативной устойчивости. Таким образом, коллоидные растворы с ионным стабилизатором агрегативно неустойчивы, если их мицеллы имеют ζ<30 мВ относительно устойчивы, если 30 < ζ < 50 мВ и устойчивы, если ζ > 50т мВ.
Коагуляция. Пептизация
Лиофобные коллоидные растворы, как термодинамически неустойчивые системы, могут разрушаться самопроизвольно или под влиянием внешних воздействий. Разрушение коллоидных растворов начинается с их коагуляции.
Коагуляциейназывается процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
В результате коагуляции укрупненные частицы дисперсной фазы легко седиментируют, и происходит расслоение системы. Таким образом, причиной коагуляции является потеря агрегативной устойчивости коллоидным раствором, а следствием коагуляции - уменьшение его седиментационной устойчивости.
Практически коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др.
Явление коагуляции лежит в основе многих патологических процессов, протекающих в живых системах. Коагуляция коллоидных растворов фосфата кальция и холестерина в крови приводит к образованию осадков и отложению их на внутренней поверхности кровеносных сосудов (атеросклеротические изменения сосудов).
Коагуляция проявляется в процессе свертывания крови. Свертывание крови играет в организме две противоположные роли: с одной стороны, уменьшает потерю крови при повреждении ткани, с другой - вызывает образование тромбов в кровеносной системе. Свертывание крови - очень сложный ферментативный процесс. Одновременно в крови действует антисвертывающая система, основой которой является гепарин - антикоагулянт крови.
Природу крови необходимо учитывать при ее консервировании. Так как свертыванию крови способствуют катионы кальция, то их удаляют из крови, предназначенной для консервирования, используя различные физико-химические способы. Например, добавка цитрата натрия переводит кальций в осадок, после чего кровь сохраняется в охлажденном состоянии, оставаясь пригодной для переливания в течение 30 суток. Цельную кровь можно декальцинировать также методом ионообмена, используя для этого Na-катиониты.
Коагуляция под действием электролитов. В биологических системах наибольшее практическое значение имеет коагуляция при добавлении небольших количеств электролита, поскольку коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами. Коагуляцию коллоидного раствора может вызвать любой электролит. Однако для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции (Спк).
Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызвать явную коагуляцию (заметную на глаз) - помутнение раствора или изменение его окраски. Порог коагуляции можно рассчитать по формуле:
Спк = 
где Сэл - исходная концентрация раствора электролита; Vэл - объем раствора электролита, добавленного к коллоидному раствору; Vкp -объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующим действием (у): у=1/Спк
Коагулирующее действие электролитов на коллоидные растворы с ионным стабилизатором подчиняется правилу Шульце-Гарди: коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда, противоположный заряду гранул. Коагулирующее действие ионов (у) тем сильнее, чем выше заряд иона-коагулянта.
Коагулирующее действие иона-коагулянта прямо пропорционально его заряду в шестой степени: у = f(z6). Например, коагуляция золя AgI с отрицательно заряженными гранулами (потенциалопределяющие ионы - анионы I-) происходит за счет действия положительно заряженных ионов. Поэтому при добавлении к этому золю растворов NaCl, CaCl2, AlCl3 коагулирующее действие катионов Na+, Са2+, А13+ будет резко возрастать; y(Na+):у(Са2+):у(Аl3+) = 1:64:729. Коагуляция золя AgI с положительно заряженными гранулами (потенциалопределяющие ионы-катионы Ag+), наоборот, идет за счет отрицательно заряженных ионов. Добавление к золю растворов КCl, K2SO4, К3[Fе(СN)6] вызовет увеличение коагулирующего действия анионов в следующем порядке: у(Сl-):y(SO4(2-)):y[Fe(CN)6]3- = 1:64:729.
От правила Шульце-Гарди встречаются отклонения, поскольку на коагулирующее действие иона кроме заряда влияют радиус коагулирующего иона, а также природа иона, сопутствующего иону-коагулянту.
Сильное влияние электролита на коагуляцию коллоидных растворов следует учитывать при введении растворов солей в живые организмы. При этом имеет значение не только концентрация, но и заряд вводимых ионов. Так, физиологический раствор хлорида натрия (0,9%) нельзя заменить изотоническим раствором сульфата магния, поскольку в этой соли имеются двухзарядные ионы Mg2+ и SО4(2-), обладающие более высоким коагулирующим действием, чем ионы Na+ и Сl-.
При инъекциях электролита в мышечную ткань или кровь человека необходимо вводить его постепенно, медленно, чтобы не вызвать коагуляцию биологических коллоидных систем. Быстрое введение электролита из-за малой скорости диффузии его в крови или мышечной ткани приводит к накоплению электролита, локальному (местному) превышению его пороговой концентрации и вызывает коагуляцию биосубстратов, которую трудно остановить. При медленном введении электролит успевает уноситься с током крови и диффундировать в соседние ткани, поэтому пороговая концентрация не достигается и коагуляция не наступает. Это явление в живых тканях называется «привыканием».
Механизм коагуляции. Роль электролитов при коагуляции заключается в уменьшении расклинивающего давления между сближающимися коллоидными частицами. Это может происходить двумя путями: за счет уменьшения заряда поверхности твердой фазы (заряда поверхности ядра), т.е. за счет снижения межфазного потенциала Фмф, или за счет уменьшения толщины (сжатия) ионных атмосфер мицелл при неизменном заряде поверхности их ядер. В связи с этим возможны два вида коагуляции: нейтрализационная и концентрационная.
Нейтрализационная коагуляция наступает под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок) и тем самым уменьшая заряд поверхности ядра. Нейтрализационная коагуляция наблюдается, например, при добавлении K2S к коллоидному раствору AgI с положительно заряженными гранулами (потенциалопределяющие ионы - катионы Ag+). Между коагулирующими анионами S2- и потенциалопределяющими катионами Ag+ происходит реакция с образованием малорастворимого соединения Ag2S, что приводит к разрушению мицеллы AgI:

В результате связывания потенциалопределяющих катионов Ag+ межфазный потенциал Фмф падает и число противоионов NO3(-), необходимых для компенсации заряда поверхности ядра, уменьшается. Таким образом, ионные атмосферы вокруг ядер становятся тоньше, снижается расклинивающее давление между сближающимися частицами, а это в свою очередь приводит к их слипанию в более крупные агрегаты.
Концентрационная коагуляция наступает под действием электролита, который химически не взаимодействует с ионами стабилизатора и не изменяет заряд поверхности ядра мицеллы. Однако в этом случае коагулирующее действие проявляют те ионы добавленного электролита, которые являются противоионами для данных мицелл, так как за счет повышения их концентрации они проникают внутрь гранулы, сжимая (уплотняя) ионную атмосферу мицеллы вокруг ядра. Концентрационная коагуляция происходит при неизменном межфазном потенциале Фмф, но сопровождается, как правило, уменьшением ζ-потенциала. Концентрационная коагуляция наблюдается, например, при добавлении нитратов к коллоидному раствору AgI, мицеллы которого содержат противоионы NО3(-):

По мере увеличения концентрации добавляемых ионов NO3(-) они способствуют внедрению противоионов диффузного слоя в адсорбционный слой. При этом диффузный слой сжимается, и может наступить такое состояние, при котором диффузный слой исчезнет вовсе и гранула станет электронейтральной. В таком состоянии расклинивающее давление между сближающимися частицами минимально, и это приводит к слипанию частиц в более крупные агрегаты.
Поскольку заряд гранул в этих условиях равен 0, то в электрическом поле они не приобретают направленного движения к электродам, так как гранула находится в изоэлектрическом состоянии.
Изоэлектрическим состоянием называется состояние коллоидных частиц, при котором электрокинетический потенциал ζ равен 0 и которое характеризуется отсутствием направленного движения гранул в электрическом поле.
В агрегативно-устойчивом состоянии коллоидного раствора значение колеблется в пределах 50-70 мВ. При уменьшении ζ-потенциала под действием электролита до 25-30 мВ в системе не наблюдается никаких внешних изменений (помутнения или изменения окраски), так как скорость коагуляции еще очень низкая, вследствие чего эта стадия (I) коагуляции называется «скрытой» коагуляцией (рис. 6.10). Дальнейшее добавление электролита свыше Спк вызывает еще большее сжатие диффузного слоя и уменьшение ζ-потенциала , что сопровождается помутнением раствора, и начинается «явная» коагуляция. Вначале скорость коагуляции быстро увеличивается (стадия II), а затем становится постоянной, когда значение ζ-потенциаластанет равным нулю и наступит стадия быстрой коагуляции (III).
Коагуляция смесями электролитов. На практике коагуляция часто вызывается действием смеси электролитов. При этом существует три возможных варианта взаимодействия между электролитами: аддитивное действие, антагонизм и синергизм.
 |
Рис. 6.10. Влияние концентрации электролитана скорость коагуляции
Аддитивность - это суммирование коагулирующего действия ионов, вызывающих коагуляцию.
Аддитивное действие проявляется в тех случаях, когда электролиты, содержащие коагулирующие ионы, не взаимодействуют химически между собой. Например, смесь солей КСl и NaNО3 проявляет аддитивное действие по отношению к коллоидным растворам как с отрицательно, так и с положительно заряженными гранулами. В первом случае коагуляцию вызывают катионы К+ и Na+, во втором - анионы Сl- и NO3(-).
Антагонизм - это ослабление коагулирующего действия одного электролита в присутствии другого.
Pb2+ + 2Cl- = PbCl2↓
Антагонизм действия наблюдается в тех случаях, когда в результате химической реакции между электролитами коагулирующие ионы связываются в нерастворимое соединение (выпадают в осадок) либо в прочный комплекс, который не обладает коагулирующей способностью. Например, коагулирующее действие катионов Рb2+ по отношению к отрицательно заряженным гранулам ослабляется в присутствии NaCl, так как протекает реакция, в результате которой уменьшается концентрация коагулирующих ионов Рb2+ в растворе из-за выпадения в осадок РbСl2:
Синергизм - это усиление коагулирующего действия одного электролита в присутствии другого.
Синергизм действия возможен, когда между электролитами происходит химическое взаимодействие, в результате которого образуется многозарядный ион, обладающий очень высокой коагулирующей способностью. Например, коагулирующее действие FeCl3 и KCNS по отношению к положительно заряженным гранулам (коагулирующие ионы Сl(-) и CNS-) усиливается во много раз, так как происходит реакция, в результате которой образуются многозарядные анионы [Fe(CNS)6]3-, проявляющие высокую коагулирующую способность:
FeCl3 + 6KCNS → K3[Fe(CNS)6] + 3KCl
Используя электролиты в лабораторной и медико-санитарной практике, необходимо всегда учитывать возможность коагуляции в биологических средах. Так, при введении различных лекарственных веществ в организм (в виде инъекций) следует предварительно убедиться в том, что эти вещества не являются синергистами, чтобы избежать возможной коагуляции. С другой стороны, при очистке промышленных вод вредным может оказаться антагонизм вводимых электролитов, препятствующий разрушению коллоидных загрязнений.
В природных водах, как и в промышленных сточных водах, коагуляция нередко происходит в результате смешивания дисперсных систем, содержащих разнородные частицы. Гетерокоагуляциейназывается коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Частным случаем гетерокоагуляции является взаимная коагуляция - слипание разноименно заряженных гранул коллоидных растворов. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды гранул.
Гетерокоагуляции широко используется на практике в связи с проблемой очистки природных и промышленных вод. В воду, содержащую коллоидные примеси, добавляют соли алюминия или железа (3), которые являются хорошими коагулянтами. Эти соли в результате гидролиза дают малорастворимые гидроксиды Аl(ОН)3 или Fe(OH)3, образующие коллоидные растворы с положительно заряженными гранулами. В результате происходит коагуляция, сопровождающаяся образованием хлопьев из агрегированных разнородных мицелл, которые выпадают в осадок.
В процессе коагуляции, связанной с потерей агрегативной устойчивости, происходит разрушение коллоидного раствора, сопровождающееся выпадением осадка - коагулята. Однако, если коагуляту возвратить агрегативную устойчивость, то может произойти обратный процесс - пептизация.
Пептизациейназывается процесс, обратный коагуляции - превращение осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
Пептизация может проводиться двумя путями, каждый из которых приводит к увеличению агрегативной устойчивости за счет восстановления достаточно рыхлых ионных атмосфер у мицелл:
· промыванием коагулята чистым растворителем (дисперсионной средой), что приводит к вымыванию из системы ионов, вызвавших коагуляцию, и разрыхлению ионных атмосфер вокруг частиц;
· добавлением специального электролита-пептизатора, ионы которого, адсорбируясь на поверхности частиц коагулята, восстанавливают рыхлые ионные атмосферы вокруг этих частиц и способствуют переходу их в коллоидное состояние.
Однако не всякий полученный при коагуляции осадок поддается пептизации. Важнейшие условия эффективной пептизации заключаются в следующем:
· к пептизации способны только свежеполученные осадки, так как увеличение продолжительности контакта частиц дисперсной фазы между собой приводит к постепенному уплотнению осадка и вытеснению жидкой фазы из его структуры;
· необходимо добавление небольших количеств электролита-пептизатора, в ином случае может вновь наступить коагуляция;
· пептизации способствуют перемешивание и нагревание.
Процесс пептизации лежит в основе лечения ряда патологических изменений в организме человека: рассасывания атеросклеротических бляшек на стенках кровеносных сосудов, почечных и печеночных камней или тромбов в кровеносных сосудах под действием антикоагулянтов. При этом необходимо учитывать своевременность введения лекарственных веществ (антикоагулянтов) в кровь: застарелые тромбы в кровеносных сосудах, а также уплотнившиеся камни практически не пептизируются, т.е. не рассасываются.
6.9. Грубодисперсные системы: суспензии, эмульсии, аэрозоли
Грубодисперсные системы делятся на три группы: эмульсии, суспензии и аэрозоли.
Эмульсии – это дисперсные системы с жидкой дисперсионной средой и жидкой дисперсной фазой.
Их можно также разделить на две группы:
1. прямые – капли неполярной жидкости в полярной среде (масло в воде);
2. обратные (вода в масле).
Изменение состава эмульсий или внешнее воздействие могут привести к превращению прямой эмульсии в обратную и наоборот. Примерами наиболее известных природных эмульсий являются молоко (прямая эмульсия) и нефть (обратная эмульсия). Типичная биологическая эмульсия – это капельки жира в лимфе. В химической технологии широко используют эмульсионную полимеризацию как основной метод получения каучуков, полистирола, поливинилацетата и др.
Суспензии – это грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой.
Особую группу составляют грубодисперсные системы, в которых концентрация дисперсной фазы относительно высока по сравнению с ее небольшой концентрацией в суспензиях. Такие дисперсные системы называют пастами. Например, вам хорошо известные из повседневной жизни зубные, косметические, гигиенические и др.
Аэрозоли – это грубодисперсные системы, в которых дисперсионной средой является воздух, а дисперсной фазой могут быть капельки жидкости (облака, радуга, выпущенный из баллончика лак для волос или дезодорант) или частицы твердого вещества (пылевое облако, смерч).
Коллоидные системы занимают промежуточное положение между грубодисперсными системами и истинными растворами. Они широко распространены в природе. Почва, глина, природные воды, многие минералы, в том числе и некоторые драгоценные камни, – все это коллоидные системы.
Большое значение имеют коллоидные системы для биологии и медицины. В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложном взаимоотношении с окружающей средой. С химической точки зрения организм в целом – это сложнейшая совокупность многих коллоидных систем.
Коллоидные системы подразделяют на золи (коллоидные растворы) и гели (студни).
Большинство биологических жидкостей клетки (цитоплазма, ядерный сок – кариоплазма, содержимое вакуолей) и живого организма в целом являются коллоидными растворами (золями).
Для золей характерно явление коагуляции, т.е. слипания коллоидных частиц и выпадение их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (яичный белок, клеи) или при изменении кислотно-основной среды (пищеварительные соки).
Гели – это коллоидные системы, в которых частицы дисперсной фазы образуют пространственную структуру.
Гели – это дисперсные системы, которые встречаются вам в повседневной жизни.
Со временем структура гелей нарушается – из них выделяется жидкость. Происходит синерезис – самопроизвольное уменьшение объема геля, сопровождающееся отделением жидкости. Синерезис определяет сроки годности пищевых, медицинских и косметических гелей. Очень важен биологический синерезис при приготовлении сыра, творога.
По внешнему виду истинные и коллоидные растворы трудно отличить друг от друга. Чтобы это сделать, используют эффект Тиндаля – образование конуса «светящейся дорожки» при пропускании через коллоидный раствор луча света. Частицы дисперсной фазы золя отражают своей поверхностью свет, а частицы истинного раствора – нет. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в кинотеатре при прохождении луча света от киноаппарата через запыленный воздух зрительного зала.
6.10. Электрокинетические явления в дисперсных системах: электрофорез, электроосмос
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез - это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 6.11, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
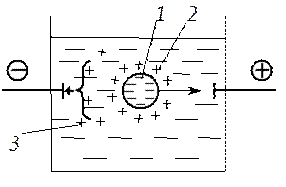
Рис. 6.11. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху - электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.

Рис. 6.12. Схема электроосмоса
1 - дисперсная система; 2 - перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
