I. реакции на катионы
Химические методы анализа
Общие реакции на подлинность
Испытание на подлинность - это подтверждение идентичности анализируемого лекарственного средства или лекарственной формы на основании требований ГФ или другой НД.
Подлинность неорганических лекарственных средств устанавливается путём обнаружения катионов и анионов, а органических - по функциональным группам с помощью различных типов химических реакций (осаждения, окисления-восстановления, комплексообразования, разложения, конденсации и др.).
В ГФ XI, вып. 1, в разделе «Химические методы анализа. Общие реакции на подлинность» (с.159-165) приведены унифицированные методики для идентификации ионов и некоторых функциональных групп.
Для определения подлинности лекарственного средства рассчитывают навеску с учётом чувствительности реакции. Чувствительность характеризуется минимальным количеством анализируемого г/иона, которое удаётся обнаружить с помощью данной реакции, при соблюдении необходимых условий её выполнения. Обычно навески, указанные в методиках выше, чем установленная чувствительность реакции.
В большинстве общих методик, приведённых в ГФ указана масса иона в граммах, необходимая для выполнения реакции. Для того, чтобы провести реакцию на конкретное лекарственное вещество необходимо сделать расчет навески.
Пример расчёта навески для определения
Провести испытание калия йодида по показателю «Подлинность» (ФС 42-3805-99)
1-я реакция на ион калия (ГФ XI, вып. 1, с. 161). масса иона калия:
0,01 - 0,02 г
Молекулярная масса KI - 166,01
Ионная масса калия - 39,09
Расчёт навески (а): 166,01 г KI содержит 39,09 г иона К,
а, г KI – 0,01 г иона К
а min=166.1×0.01/39.09=0.04 г
166,01 г - 39,09 г
а, г KI - 0,02 г иона К а max= 166.01x0.02/39,09 = 0.08 г
АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ
НЕОГРАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ.
I. РЕАКЦИИ НА КАТИОНЫ
1. Ион аммония (NH4+)
1.ГФРастворы едких щелочей (NaOH, KOH) выделяют из растворов солей аммония при нагревании газообразный аммиак (реакция разложения).
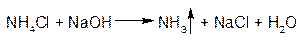
Выделяющийся аммиак обнаруживают следующими способами:
1) по характерному запаху аммиака;
2) по посинению красной лакмусовой бумажки или по покраснению бесцветной фенолфталеиновой;
3) если к отверстию пробирки поднести фильтровальную бумагу, смоченную раствором нитратом ртути (I), на ней появляется чёрное пятно вследствие выделения металлической ртути:
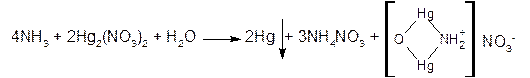
2. Реактив Несслера – раствор тетрайодмеркурата (II) калия в КОН – K2[HgI4] образует с солями аммония желтое окрашивание (следы аммония) или желто-бурый осадок:
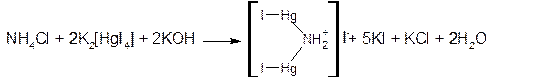
2. Ион натрия (Na+)
1. ГФСоль натрия, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
2. ГФСоли натрия образуют желтый кристаллический осадок с цинка уранилацетатом в уксуснокислой среде.
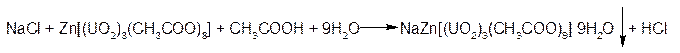
Осадок нерастворим в уксусной кислоте.
3. ГФ ХII (вместо реакции 2.) К 2 мл раствора натриевой соли (7–10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и
нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки
3. Ион калия (К+)
1. ГФСоль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет, а при рассмотрении через синее стекло пламя имеет пурпурно-красный цвет.
2. ГФСоли калия с раствором винной кислоты в присутствии натрия ацетата и спирта образуют белый осадок кислой соли калия гидротартрата. Осаждению способствует: охлаждение растворов, встряхивание пробирки и потирание стеклянной палочкой о стенки пробирки.

Реакция проводится в среде натрия ацетата, необходимого для связывания выделяющихся ионов водорода. При этом образуется уксусная кислота, в которой осадок КНС4Н4О6 нерастворим:
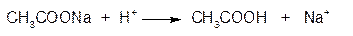
Осадок калия гидротартрата растворяется в минеральных кислотах и растворах едких щелочей:
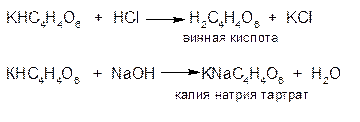
3.ГФСоли калия с натрия кобальтинитритом (гексанитро (III) кобальтатом натрия) в уксуснокислой среде; образуют желтый кристаллический осадок гексанитро(III) кобальтата калия и натрия.
KCI + Na3[Co(NO2)6]→ K2Na[Co(NO2)6]↓ + 2KNO3
4. Ион кальция (Са2+)
1. ГФСоль кальция, смоченная хлористоводородной кислотой, окрашивает бесцветное пламя горелки в кирпично-красный цвет.
2. ГФРаствор аммония оксалата осаждает из растворов солей кальция белый осадок кальция оксалата:

Осадок растворим в разведенных минеральных кислотах и нерастворим в уксусной кислоте:

5. Ион магния (Mg2+)
ГФСоли магния с раствором натрия гидрофосфата в присутствии аммония гидроксида и аммония хлорида образует белый кристаллический осадок магний-аммоний фосфата:
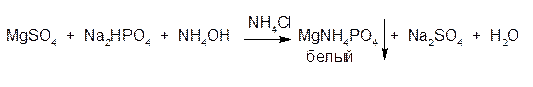
Осадок растворяется в минеральных кислотах и уксусной кислоте:

Реакцию осаждения магний-аммоний фосфата проводят в присутствии аммония хлорида во избежание выпадения в щелочной среде осадка Mg(OH)2. Следует избегать и избытка NH4CI, так как в этом случае образуются растворимые комплексы [MgCI3]- и [MgCI4]2-.
6. Ион железа (II) (Fe2+)
1.ГФ Натрия сульфид образует с солями Fe2+ черный осадок:
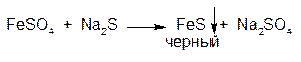
Осадок растворим в минеральных кислотах:
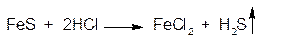
2.ГФРастворы солей железа (II) с раствором калия феррицианида (гексацианоферратом (III) калия) образуют синий осадок феррицианида железа(II) (гексацианоферрата(III) железа(II)) «турнбулевая синь», возможно также образование KFe[Fe(CN6)]:
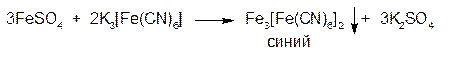
Осадок нерастворим в минеральных кислотах, но разрушается едкими щелочами с образованием гидроксида железа (II) – зеленый осадок, буреющий на свету:
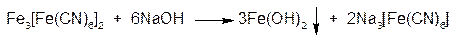
7. Ион железа (III) (Fe3+)
1.ГФ Натрия сульфид осаждает из растворов солей железа (III) осадок сульфида железа черного цвета:
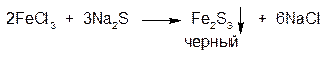
Осадок растворим в минеральных кислотах:

2.ГФ Растворы солей железа (III) образуют в кислой среде хлористоводородной кислоты разведенной с раствором калия ферроцианида (гексацианоферрата (II) калия) синий осадок «берлинской лазури»:
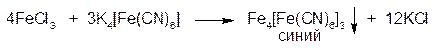
Осадок нерастворим в минеральных кислотах, но разрушается едкими щелочами с образованием бурого осадка Fe(OH)3:
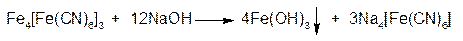
3. ГФ При добавлении к раствору соли Fe3+ раствора аммония тиоцианата образуется тиоцианат железа красного цвета:

8. Ион серебра (I) (Аg+)
1.Реакция восстановления Ag+ из аммиачного раствора серебра нитрата до металлического серебра при нагревании с раствором формальдегида (реакция «серебряного зеркала»):
AgNO3 + 2NH4OH →[Ag(NH3)2]NO3 + 2Н2O
t0
2[Ag(NH3)2]NO3 + HCOH + H2O → 2Ag↓ + HCOONH4 + 2NH4NO3 + NH3↑
Металлическое серебро образует на стенках пробирки тонкую блестящую пленку - «серебряное зеркало».
2. Реакция осаждения кислотой хлороводородной или натрия хлоридом. Образуется белый творожистый осадок AgCl:
AgNO3 + HCl → AgCl↓+HNO3
Белый творожистый
Осадок серебра хлорида нерастворим в кислоте азотной разведенной, растворяется в растворе аммиака с образованием комплексного соединения:
AgCl + 2NH4OH→[Ag(NH3)]Cl + 2Н2O
3. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
2AgN03 + 2NH4OH → Ag2O↓ + 2NH4NO3
черный осадок
Осадок серебра оксида нерастворим в избытке натрия гидроксида, растворяется в избытке раствора аммиака с образованием комплексного соединения:
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH +ЗН2O
9. Ион цинка (Zn2+)
1. ГФРастворы солей цинка образуют с сульфид-ионом осадок цинка сульфида белого цвета:
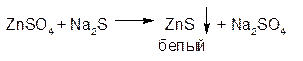
Осадок легко растворим в разведенной соляной кислоте и нерастворим в уксусной:

2. ГФСоли цинка с гексацианоферратом (ΙΙ) калия образуют белый студенистый осадок гексацианоферрата (ΙΙ) цинка:
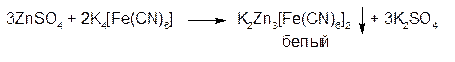
Осадок нерастворим в разведенных минеральных кислотах, растворим в щелочах.
3.Раствор гидроксида натрия выделяет из растворов солей цинка белый студенистый осадок Zn(OH)2, растворимый в избытке реактива с образованием цинкатов:
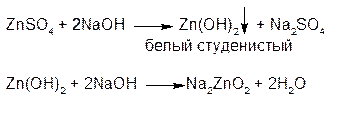
доказывает амфотерность Zn2+ цинка и растворимость оксида в кислотах и щелочах
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
10. Ион свинца (Pb2+)
1. Калия йодид образует с солями свинца (ΙΙ) желтый осадок дийодида свинца, растворимый в избытке реактива с образованием бесцветного раствора:
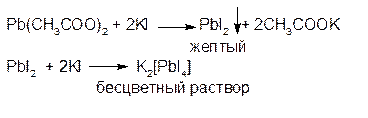
2. Растворы хромата калия и дихромата калия образуют с растворами солей свинца желтый осадок хромата свинца:
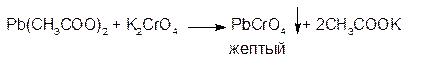
11. Ион висмута (Bi3+)
1.ГФ Йодид калия из подкисленных растворов солей висмута выделяет черный осадок, который растворяется в избытке реактива с образованием раствора оранжево-желтого цвета (осаждение с последующим комплексообразованием):
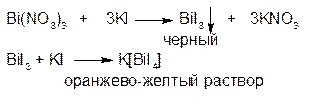
2.ГФ Соли висмута с натрия сульфидом образуют коричневато-черный осадок висмута сульфида, растворимый в концентрированной азотной кислоте.
2BiCl3+3Na2S → Bi2S3↓+3NaCl
12. Ион меди (Cu2+)
1. Раствор аммиака осаждает сначала из растворов солей меди (ΙΙ) осадок основной соли голубовато-зеленого цвета, который растворяется в избытке реактива с образованием окрашенного в интенсивно-синий цвет прозрачного комплекса:
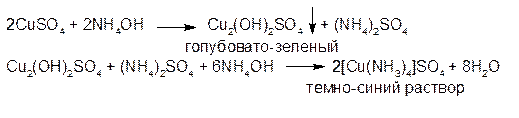
2. Гексацианоферрат (II) калия образует с солями меди (II) красно-бурый осадок гексацианоферрата (II) меди:

13. Ион ртути (II) (Нg2+)
1.ГФ Растворы солей ртути (II) с эквимолекулярным количеством йодида калия образуют красный осадок дийодида ртути, растворимый в избытке реактива.
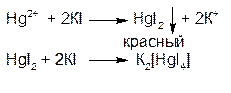
2. ГФ При действии щелочей на водные растворы солей ртути (II) образуется желтый осадок ртути оксида (II):
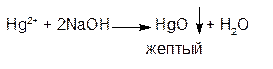
14. Алюминий (Аl3+)
1. ГФ ХIIОколо 15 мг лекарственного средства растворяют в 2 мл
воды. К полученному раствору или к 2 мл раствора, приготовленного как
указано в частной фармакопейной статье, прибавляют 0,5 мл хлористоводо-
родной кислоты разведенной 8,3 % и 0,5 мл реактива тиоацетамида; осадок
не образуется. Затем по каплям прибавляют раствор натрия гидроксида раз-
веденный 8,5 %; образуется гелеобразный белый осадок, растворимый при
последующем прибавлении раствора натрия гидроксида разведенного 8,5 %.
Постепенно прибавляют 10 % раствор аммония хлорида; снова образуется
гелеобразный белый осадок.
2.Реакция осаждения раствором натрия гидроксида или раствором аммиака:
Al3+ + 3NaOH →Al(OH)3↓ + 3Na+
Эквив. Белый желатинообразный осадок
Al3+ + 3NH4OH→Al(OH)3↓ + 3NH4+
Al(OH)3 + NaOH → NaAl(OH)4↓
| Реакция прокаливания с раствором кобальта нитрата: 4А13+ + 2Со(NОз)2 → 2Со(АlO2)2 + 4NO↑ |
Плав синего цвета
