Вычисление спектра буферной емкости белка
Буферную емкость белка (β)на заданном участке значений рН можно вычислить по следующей формуле:
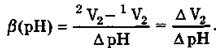 |
Спектр буферной емкости исследуемого вещества описывается дифференциальным уравнением вида:
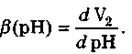
Чем меньше величина приращения рН (ΔрН), тем ближе вычисленный спектр буферной емкости к теоретическому.
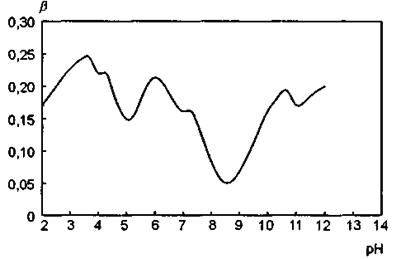
Рис. 4. Спектр буферной емкости (β,мкг-экв/мл) белкового раствора в интервале рН 2—12 (ΔрН = 0,2)
Экспериментальная часть
Выделение из крови оксигемоглобина по методу Д.Л.Драбкина с модификацией Л.А.Блюменфельда.
В опытах используют водно-солевые растворы оксигемоглобина в концентрации 5-10-5 моль/л, который выделяют из эритроцитов путем их осмотического гемолиза.
Кровь, содержащую небольшое количество антикоагулянта (цитрат натрия или гепарин), смешивают с равным объемом изотонического (0,85%-го) раствора хлорида натрия. Смесь центрифугируют в течение 10 мин при 6000 об/мин на центрифуге ЦЛН-2. Надосадочную жидкость, содержащую плазму и тонкий слой лейкоцитов, осторожно удаляют пипеткой. К осадку, содержащему эритроциты, добавляют 0,85%-ый раствор NaCl до исходного объема, осторожно перемешивают и снова центрифугируют при тех же условиях.
К полученной отмытой эритроцитарной массе в качестве гемо-лизирующего агента добавляют дистиллированную воду. Гемолиз проводят в течение 3 мин при периодическом перемешивании. Мембраны эритроцитов осаждают центрифугированием в течение 15 мин при 8000 об/мин. Надосадочная жидкость содержит преимущественно раствор оксигемоглобина. Полученный раствор разбавляют до необходимой концентрации, которую определяют спектрофотометрически с использованием формулы:
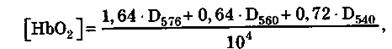
где [НbО2] — концентрация оксигемоглобина; D576, D560, D540 — значения оптической плотности исследуемого раствора оксигемоглобина при длинах волн 576, 560 и 540 нм соответственно.
Опыт 1. Изучение буферных свойств растворов гемоглобина
Цель работы: исследовать буферные свойства молекул гемоглобина методом кислотно-основного титрования.
Задачи:
1) измерить общую буферную емкость раствора белка в интервале рН = 3,0-11,5;
2) определить количество титруемых ионогенных групп в заданных областях рН (3,0-5,0; 5,0-9,0; 9,0-11,5);
3) сравнить полученное число ионогенных групп с общим количеством групп, доступных для титрования при нормальных условиях, а также с общим числом способных к диссоциации групп в молекуле белка.
Материалы и оборудование: установка для регистрации кривых кислотно-основного титрования, секундомер, 0,2 М раствор хлорида калия, раствор оксигемоглобина в 0,2 М КС1, соляная кислота, гидроксид калия.
Ход работы
Приготовить водно-солевые растворы НbO2 (сб = 5-10-5 моль/л) по методике, описанной выше. Подготовить установку для КОТ к работе:
а) включить и прогреть иономер в течение 30 мин;
б) настроить иономер по стандартным буферным растворам (рН = 4,01; 6,86; 9,18 при комнатной температуре);
в) установить требуемую скорость истечения титранта (100-300 мкл/мин);
г) прилить в ячейку с исследуемым раствором аликвоту соляной кислоты до его закисления до значения рН=1,5-2,0;
д) включить одновременно подачу титранта и секундомер. Через каждые 10-15 секунд регистрировать рН раствора. Титрование завершить при достижении рН=12,0.
Проведение опыта включает в себя два этапа:
1) титрование растворителя (КС1);
2) титрование раствора белка.
Каждый из этапов повторить не менее 3 раз. После каждого процесса титрования необходимо тщательно промывать электроды 2-4 порциями дистиллированной воды.
По результатам каждого титрования построить графики зависимости рН от количества прилитого титранта и определить графическим способом на кривой титрования величины 1V2 и 2V2 (см. рис. 3) в выбранных областях рН. Результаты занести в таблицу 3.
По средним значениям 1V2 и 2V2 вычислить для указанных интервалов рН буферную емкость раствора гемоглобина и количество титруемых ионогенных групп. Результаты занести в таблицу 4.
Таблица 3 – Результаты кислотно-основного титрования раствора гемоглобина
| № опыта | 1V2 в интервале рН…, мкл | 2V2 в интервале рН…, мкл | ||||
| 3,0-5,0 | 5,0-9,0 | 9,0-11,5 | 3,0-5,0 | 5,0-9,0 | 9,0-11,5 | |
| xср |
Таблица 4 – Рассчитанные значения параметров, характеризующих буферные свойства гемоглобина
| Показатель | ΔрН | ||
| 3,0-5,0 | 5,0-9,0 | 9,0-11,5 | |
| Буферная емкость (β), мкг-экв/мкл | |||
| Число титруемых ионогенных групп (N) |
На основании вычисленных β и N провести сравнительный анализ величин, отражающих число ионогенных групп, полученных экспериментально, с их общим количеством в молекуле белка.
Опыт 2. Изучение термоиндуцированных изменений в структуре молекулы белка методом кислотно-основного титрования
Цель работы: исследовать зависимость изменений структурных свойств гемоглобина от температуры в интервале 20-600С.
Задачи:
1) измерить общую буферную емкость растворов нативного и термостатированного белка;
2) определить количество титруемых ионогенных групп в заданных областях рН (3,0-5,0; 5,0-9,0; 9,0-11,5);
3) сравнить полученное в опыте число ионогенных групп с общим количеством групп, доступных для титрования при нормальных условиях, а также с общим числом способных к диссоциации групп в молекуле белка.
Материалы и оборудование: установка для регистрации кривых кислотно-основного титрования, секундомер, раствор хлорида калия (0,2 моль/л), раствор оксигемоглобина в растворе КС1, соляная кислота, гидроксид калия, водяная баня.
Ход работы
Приготовить водно-солевые растворы НbО2 (сб = 5-10-5 моль/л) по методике, описанной выше.
Опытные образцы растворов гемопротеида поместить на водяную баню и инкубировать в течение 20 мин при температуpax 20, 40, 50, 55, 600С. Для каждого значения температуры опыт необходимо повторить в 2-3 повторностях (n).
Для достижения температурного равновесия термостатированные растворы белка выдержать при комнатной температуре в течение 15 мин.
Провести титрование (в двух-трех повторностях):
1) растворителя;
2) растворов нативного белка (контроль);
3) растворов термостатированного белка.
Провести статистическую обработку полученных данных и по средним значениям их величин вычислить:
а) буферную емкость растворов нативного и термостатированного гемоглобина;
б) по приведенным выше формулам — количество титруемых ионогенных групп;
в) полученные результаты занести в таблицу 5.
Таблица 5 – Рассчитанные значения параметров, характеризующих буферные свойства нативного и модифицированного прогреванием гемоглобина
| Показатель | Температура прогревания | ΔрН | ||
| 3,0-5,0 | 5,0-9,0 | 9,0-11,5 | ||
| Буферная емкость (β), мкг-экв/мкл | контроль (до прогревания) | |||
| Число титруемых ионогенных групп (N) | контроль (до прогревания) | |||
На основании вычисленных значений βи N провести анализ влияния прогревания гемоглобина при различных температурах на конформацию белка и его кислотно-основные свойства.
Опыт 3. Влияние некоторых химических агентов на буферную емкость белков
Цель работы: исследовать влияние различных химических соединений на буферные свойства гемоглобина методом кислотно-основного титрования.
Задачи:
1) измерить общую буферную емкость растворов нативного и химически измененного белка;
2) определить количество титруемых ионогенных групп в заданных областях рН (3,0-5,0; 5,0-9,0; 9,0-11,5);
3)сравнить полученное в опыте число ионогенных групп с общим количеством групп, доступных для титрования интактного белка, а также с общим числом способных к диссоциации групп в молекуле гемоглобина.
Материалы и оборудование: установка для регистрации кривых кислотно-основного титрования, секундомер, раствор хлорида калия (0,2 моль/л), раствор оксигемоглобина в растворе КС1, соляная кислота, гидроксид калия.
Ход работы
Приготовить:
а) водно-солевые растворы НbО2 (сб = 1∙10-4 моль/л);
б) растворы химических реагентов в концентрациях, превышающих в два раза их конечные концентрации при модификации белка (например, 20%-й раствор этилового спирта). Перечень агентов и их концентрации дает преподаватель.
Методом половинного разведения приготовить рабочие растворы требуемых концентраций (например, сб = 5∙10-5 моль/л в 10%-м растворе этилового спирта).
Провести титрование (в двух-трех повторностях):
а) растворов нативного белка (контроль);
б) растворов модифицированного белка.
Провести статистическую обработку полученных данных и по средним значениям их величин вычислить:
а) буферную емкость растворов нативного и модифированного гемоглобина;
б) по приведенным выше формулам — количество титруемых ионогенных групп;
в) относительную буферную емкость опытных образцов в заданных областях рН (3,0-5,0; 5,0-9,0; 9,0-11,5);
г) полученные результаты занести в таблицу 6.
На основании вычисленных значений βи N провести анализ зависимости величины буферной емкости и числа титруемых ионогенных групп от типа действующего агента.
Таблица 6 – Рассчитанные значения параметров, характеризующих буферные свойства нативного и модифицированного различными химическими агентами гемоглобина
| Показатель | Модифицирующий агент, его концентрация | ΔрН | ||
| 3,0-5,0 | 5,0-9,0 | 9,0-11,5 | ||
| Буферная емкость (β), мкг-экв/мкл | контроль (без модификации) | |||
| Число титруемых ионогенных групп (N) | контроль (без модификации) | |||
На основании вычисленных значений βи N провести анализ влияния различных химических агентов на конформацию белка и его кислотно-основные свойства.
Контрольные вопросы
1. Белки. Структура и свойства (ионизация, поверхностный заряд, изоэлектрическая точка, конформационная чувствительность к рН, ионной силе и температуре раствора).
2. Гемоглобин — гемопротеин, его субъединичная структура и связи, стабилизирующие ее.
3. Понятие буферной емкости растворов. Какую информацию отражает величина буферной емкости?
4. Какие структуры белка обусловливают буферную емкость его растворов?
5. Перечислите ионогенные группы белковой молекулы, их рК и структуры, определяющие эту величину.
6. Объясните различие величин рК свободных аминокислот и связанных в полипептидную цепь аминокислотных остатков.
7. Охарактеризуйте понятия: «общая буферная емкость» и «относительная буферная емкость растворов».
9. Дайте определение понятию «ионная сила раствора», объясните его физико-химический смысл. Напишите уравнение для вычисления ионной силы раствора и проанализируйте его.
10. Принципы и методы, положенные в основу регистрации КОТ.
11. Охарактеризуйте зависимость между числом ионогенных групп и величиной буферной емкости.
12. Опишите механизмы, лежащие в основе действия ряда физико-химических факторов внешней среды (температуры, рН, химических веществ различной природы, УФ-радиации и других) на конформационное состояние белков.
Список рекомендуемой литературы
1. Степанов В. М. Молекулярная биология. Структура и функции белков. — М.: Высшая школа, 1996. — С. 108—116.
2. Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия. — М.: Высшая школа, 1990. — 416 с.
3. Справочник биохимика / Р. Досон, Д. Эллиот, У. Эллиот и др. — М.: Мир, 1991. — С. 20—40.
4. Ленский А. С. Введение в бионеорганическую и биофизическую химию. — М.: Высшая школа, 1989. — 256 с.
5. Якубис X. Д., Эшнайт X. Аминокислоты. Пептиды. Белки. — М.: Мир, — 1985. — С. 416—419.
6. Шульц Г., Ширмер Р. Принципы структурной организации белков. — М.: Мир, 1982. — 292 с.
7. Ленинджер А. Биохимия. М.: Мир, 1976. — 953 с.
