Общая характеристика химического состава организма
Михайлов С.С.
Спортивная биохимия:
Учебник для вузов и колледжей физической культуры.
Биохимия изучает в самом общем виде химическую сторону жизни. Обычно выделяют три главные задачи, стоящие перед этой научной дисциплиной:
1. Изучение химического состава живого организма, строения и
свойств молекул, из которых он состоит.
2. Изучение обмена веществ, т. е. химических превращений, кото
рым подвергаются входящие в организм молекулы (раздел биохимии,
решающий эти задачи, называется «Общая биохимия»).
3. Изучение особенностей химического состава и обмена веществ
отдельных представителей живого мира(например, у микробов, расте
ний, животных), изучение химического состава и обмена веществ при
различных заболеваниях и при поступлении в организм экзогенных
веществ (ядов, лекарственных средств). К этой задаче также относится
изучение влияния на организм разнообразных физических нагрузок, в
том числе применяемых в спорте.
В целом раздел биохимии, занимающийся решением третьей задачи, называется «Функциональная, или частная, биохимия».
Направлением функциональной биохимии, исследующим влияние физических упражнений на организм спортсмена, является «Спортивная биохимия».
Биохимия как учебная дисциплина играет важную роль в подготовке специалистов в области физической культуры. Это положение можно обосновать следующим:
• Специалист в области физической культуры обязан в полной мере знать устройство объекта своей профессиональной деятельности, г. е. человека, должен иметь представление о химическом строении организма и о химических процессах, лежащих в основе жизнедеятельности.
• Тренер и преподаватель физического воспитания должны знатьособенности обмена веществ во время физической работы и отдыха, использовать эти закономерности для рационального построения тренировочного процесса, для установления оптимальных сроков восстановления.
Используя простейшие биохимические исследования, тренер и преподаватель физвоспитания должны уметь оценить соответствие физических нагрузок функциональному состоянию организма спортсмена, выявлять признаки перетренированности.
• Знание закономерностей биохимических процессов, протекающих при мышечной работе и при восстановлении, лежит в основе разработки новых методов и средств повышения спортивной работоспособности, развития скоростно-силовых качеств и выносливости, ускорения восстановления после тренировки.
Биохимия является базовой, фундаментальной дисциплиной,
создающей необходимые предпосылки для последующего освоения
других медико-биологических предметов (физиология, гигиена, спортивная медицина, валеология), а также теории и методики физической
культуры и ряда спортивно-педагогических дисциплин.
ОБЩАЯ БИОХИМИЯ
ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО СОСТАВА ОРГАНИЗМА
Организм человека имеет следующий химический состав: вода -60-65%, органические соединения -30-32%, минеральные вещества - 4%.
Наибольшее значение для живых организмов имеют органические соединения. Важнейшими классами органических соединений, входящих в живые организмы, являются белки, нуклеиновые кислоты, углеводы и липиды.
БЕЛКИ.
Белки выполняют в организме очень важные функции. К ним в первую очередь следует отнести: структурную, каталитическую, сократительную, транспортную, регуляторную, защитную, а также энергетическую. На долю белков в среднем приходится 1/6 часть от массы тела человека.
По строению белки - это высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.В состав белковых молекул могут входить десятки, сотни и тысячи остатков аминокислот. Однако все белки, независимо от происхождения, содержат лишь 20 видов аминокислот.
Строение 20 разновидностей аминокислот, входящих во все белки, можно отразить следующей формулой:
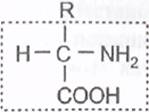 |
У всех аминокислот можно выделить общую, одинаковую часть молекулы, содержащую амино- и карбоксильную группы (выделена пунктирной рамкой). Другая же часть молекулы, обозначенная как радикал (R), у каждой из 20 аминокислот имеет специфическое строение, и аминокислоты отличаются друг от друга только радикалами. Аминокислоты, соединяясь друг с другом пептидной связью,образуют длинные неразветвленные цепи - полипептиды.Пептидная связь возникает при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты с выделением воды:
Nн2 -сн-соон +Nн2-сн-соон à
О Н
!! !
NН2 -СН – С - N -СН - СООН
Пептидная связь
Пептидные связи обладают высокой прочностью, их образуют все аминокислоты.
В состав белковой молекулы входит один или несколько полипептидов.
Кроме пептидных, в белках обнаруживаются еще дисульфидные, водородные, ионные идругие связи.
Эти химические связи могут возникать между остатками аминокислот, которые входят в разные участки одного и того же полипептида или же находятся в разных полипептидах, но обязательно пространственно сближены. В первом случае благодаря таким связям полипептидная цепь принимает определенную пространственную форму. Во втором случае с помощью непептидных связей полипептиды объединяются в белковую молекулу.
В итоге молекула белка является объемным, трехмерным образованием, имеющим определенную пространственную форму. Для удобства рассмотрения пространственного строения молекулы белка условно выделяют четыре уровня ее структурной организации.
Первый уровень пространственной организации белковой молекулы называется первичной структурой ипредставляет собой последовательность расположения аминокислот в полипептидных цепях. Фиксируется эта структура прочными пептидными связями. Другими словами, первичная структура характеризует химическое строение полипептидов, образующих белковую молекулу. Каждый индивидуальный белок имеет уникальную первичную структуру.
Второй уровень пространственной организации - вторичная структура- описывает пространственную форму полипептидных целей. Например, у многих белков полипептидные цепи имеют форму спирали. Фиксируется вторичная структура дисульфидными и различными нековалентными связями.
Третий уровень пространственной организации - третичная структура- отражает пространственную форму вторичной структуры. Например, вторичная структура в форме спирали, в свою очередь, может укладываться в пространстве в виде глобулы, т. е. имеет шаровидную или яйцевидную форму. Стабилизируется третичная структура слабыми нековалентными связами, а также дисульфидными связями и поэтому является самой неустойчивой структурой.
Пространственная форма всей белковой молекулы получила название конформация.Поскольку в молекуле белка наряду с прочными ковалентными связями имеются еще менее прочные (нековалентные) связи, то его конформация характеризуется нестабильностью и может легко изменяться. Изменение пространственной формы белка влияет на его биологические функции.
- Конформация, находясь в которой белок обладает биологической активностью, называется нагивной. Любые воздействия на белок, приводящие к нарушению этой конформации, сопровождаются частичной или полной утратой белком его биологических свойств. Изменение конформации в небольших пределах обратимо и является одним из механизмов регуляции биологических функций белков в организме.
Четвертичной структуройобладают только некоторые белки. Четвертичная структура - это сложное надмолекулярное образование, состоящее из нескольких белков, имеющих свою собственную первичную, вторичную и третичную структуры. Каждый белок, входящий в состав четвертичной структуры, называется субъединицей. Например, белок крови гемоглобин состоит из четырех субъединиц двух типов (α и β) и имеет строение α2β2- Ассоциация субъединиц в четвертичную структуру приводит к возникновению нового биологического свойства, отсутствующего у свободных субъединиц. Например, формирование четвертичной структуры в ряде случаев сопровождается появлением каталитической активности, которой нет у отдельных субъединиц.
Объединяются субъединицы в четвертичную структуру за счет слабых нековалентных связей, и поэтому четверичная структура неустойчива и легко диссоциирует на субъединицы. Образование и диссоциация четвертичной структуры является еще одним механизмом регуляции биологических функций белков.
Из всех структур белка кодируется только первичная. За счет информации, заключенной в молекуле ДНК, синтезируются полипептидные цепи (первичная структура). Высшие структуры (вторичная, третичная, четвертичная) возникают самопроизвольно в соответствии со строением полипептидов.
КЛАССИФИКАЦИЯ БЕЛКОВ.
Белки делятся на простые(протеины) и сложные(протеиды). Простые белки состоят только из аминокислот. К простым белкам, имеющимся в организме человека, относятся альбумины, глобулины, гистоны, белки опорных тканей.В молекуле сложного белка, кроме аминокислот, еще имеется неаминокислотная часть, называемая простетической группой.В зависимости от строения простетической группы выделяют такие сложные белки, как фоефопротеиды(содержат в качестве простетической группы фосфорную кислоту), нуклеопротеиды(содержат нуклеиновую кислоту), гликопротеиды(содержат углевод), липопротеиды(содержат липоид), хромопротеиды(содержат окрашенную простетическую группу) и др.
Возможна и другая классификация белков, вытекающая из их пространственной формы. В этом случае белки разделяются на два больших класса: глобулярные и фибриллярные.
Молекулы глобулярных белков имеют шарообразную или эллипсоидную форму. Примером таких белков являются альбумины и глобулиныплазмы крови.
Фибриллярные белки представляют собою вытянутые молекулы, у которых длина значительно превышает их диаметр. К таким белкам прежде всего необходимо отнести коллаген- самый распространенный белок у человека и высших животных, на долю которого приходится 25-30% от общего количества белков организма. Коллаген обладает высокой прочностью и эластичностью. Этот белок широко распространен в организме, он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, стенках сосудов, мышцах, сухожилиях, хрящах, костях, во внутренних органах.
НУКЛЕИНОВЫЕ КИСЛОТЫ
По своему строению нуклеиновые кислоты являются полинуклеотидами,состоящими из очень большого количества мононуклеотидов (нуклеотидов).Любой нуклеотид обязательно включает в себя азотистое основание(циклическое соединение, содержащее атомы азота и обладающее щелочными свойствами), углевод и фосфорную кислоту.
Азотистые основания бывают двух типов: пуриновые и пиримидиновые.
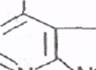
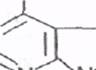
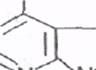
К пуриновым основаниям относятся аденин и гуанин,имеющие следующее строение:
NH2

 N
N

 N
N

N NH Аденин
О
 ║ N
║ N


 Н N
Н N
 |
NH2 
N NH Гуанин
 |
 |
 |
 |
Пиримидиновыми основаниями являются урацил, тимин и цитозин:
О NH2 O
 ║ I ║
║ I ║
 |  |


 HN N HN =CH3
HN N HN =CH3
O= O= O=
NH NH NH
Урацил Цитозин Тимин
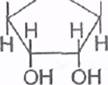
Углеводом, входящим в состав нуклеотидов, может быть рибоза или дезоксирибоза,находящиеся в циклической форме:
НО-СН2 О ОН НО-СН2 О ОН
|
| ||||
|
Рибоза Дезоксирибоза
Азотистые основания присоединяются к первому углеродному атому (С) углевода. Азотистое основание, связанное с углеводом, называется нуклеозидом.
Нуклеозиды, содержащие аденин и гуанин, называются соответственно аденозин и гуанозин,а нуклеозиды с пиримидиновыми основаниями получили названия: уридин, тимидин и цитидин.
Если в состав нуклеозида входит дезоксирибоза, то в название нуклеозида входит еще приставка «дезокси-». Например, нуклеозид, со стоящий из аденина и рибозы, называется «аденозин», а нуклеозид, содержащий аденин и дезоксирибозу, носит название «дезоксиаденозин», или в сокращенном виде «д-аденозин».
Фосфорная кислота присоединяется эфирной связью к пятому атому углерода рибозы или дезоксирибозы. Поэтому нуклеотиды можно рассматривать как нуклеозидфосфаты.
Нуклеотиды, входящие в состав нуклеиновых кислот, имеют один остаток фосфорной кислоты, а свободные нуклеотиды могут содержать от одного до трех фосфатных остатков.
Название нуклеотидов состоит из трех частей: название нуклеозида, входящего в данный нуклеотид; числительное, показывающее количество остатков фосфорной кислоты, и слово «фосфат»:
Например, нуклеотид, состоящий из аденина, рибозы и фосфорной кислоты, называется аденозинмонофосфат, или сокращенно АМФ, и имеет сле-
дующее строение:
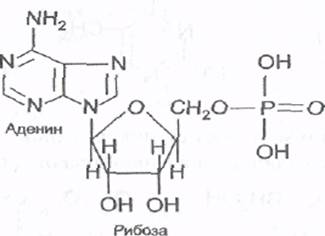 АМФ
АМФ
Нуклеотиды, входящие в нуклеиновые кислоты, соединяются друг с другом в длинные полинуклеотидные цепи эфирными связями, идущими от углевода одного нуклеотида к фосфорной кислоте соседнего:
|
Схема строения ДНК.
Один виток каждой спирали содержит 10 нуклеотидов, диаметр двойной спирали около 2 нм*. Азотистые основания обеих цепей находятся внутри двойной спирали и соединены друг с другом водородными связями. Связывание (спаривание) азотистых оснований осуществляется строго определенным образом. Аденин всегда соединяется с тимином, а гуанин - с цитозином, причем все без исключения основания одной цепи спарены с основаниями второй. Вследствие этого обе нуклеотидные цепи, образующие молекулу ДНК, имеют одинаковую длину и пространственно соответствуют друг другу. Если в каком-то месте одной цепи находится аденин, то обязательно напротив него в другой цепи присутствует тимин, а напротив гуанина всегда располагается цитозин.
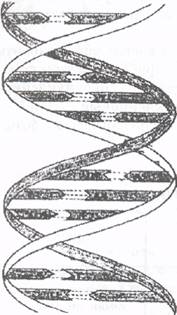 |
Такое пространственное соответствие двух полинуклеотидных цепей ДНК получило название комплементарность.Принцип комплементарности лежит в основе таких важнейших процессов, как репликация(удвоение молекулы ДНК в процессе клеточного деления), транскрипция(передача генетической информации с молекулы ДНК информационной РНК в процессе синтеза белков) и трансляция(сборка из аминокислот белковой молекулы на рибосомах).
УГЛЕВОДЫ
Углеводы - это альдегидоспирты или кетоспирты и их производные. В природе углеводы содержатся главным образом в растениях. В организме человека углеводов около 1%.
Основным природным углеводом является глюкоза,которая может находиться как в свободном виде (моносахарид), так и в составе олигосахаридов (сахароза, лактоза и др.) и полисахаридов (клетчатка, крахмал, гликоген).
Эмпирическая формула глюкозы С6Н13О6. Однако, как известно, глюкоза может иметь различные пространственные формы (ациклическую и циклические). В организме человека почти вся глюкоза (свободная и входящая в олиго- и полисахариды) находится в циклической α-пиранознойформе:
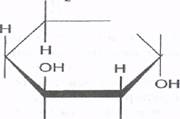 СН2ОН
СН2ОН
| Н |
НО
Н ОН ГЛЮКОЗА
Свободная глюкоза в организме человека в основном находится в крови, где ее содержание довольно постоянно и колеблется в узком диапазоне от 3,9 до 6,1 ммоль/л (70-110 мг%).
Другим углеводом, типичным для человека и высших животных, является гликоген.Состоит гликоген из сильно разветвленных молекул большого размера, содержащих десятки тысяч остатков глюкозы. Эмпирическая формула гликогена - (С6Н10О5)п (С6Н10О5 - остаток глюкозы).
Гликоген является запасной, резервной формой глюкозы. Основные запасы гликогена сосредоточены в печени (до 5-6% от массы печени) и в мышцах (до 2-3% от их массы).
Липиды
Липиды — группа разнообразных по строению веществ, обладающих одинаковыми физико-химическими свойствами: липиды не растворяются в воде, но хорошо растворимы в органических растворителях (керосин, бензин, бензол, гексан и др.).
Липиды делятся на жиры и жироподобные вещества (липоиды).
Молекула жира состоит из остатка спирта - глицеринаи трех остатков жирных кислот,соединенных сложноэфирной связью:
О
║
СН2 — О— С — R2
│ О
│ ║
СН — О — С — R1
│ О
│ ║
СН2 — О — С — R3
Жирные кислоты, входящие в состав жиров, делятся на предельные, или насыщенные, (не имеют двойных связей) и непредельные, или ненасыщенные, (содержат одну или несколько двойных связей). Наиболее часто в состав природных жиров входят жирные кислоты, содержащие 16 или 18 атомов углерода (насыщенные: пальмитиновая, стеариновая; ненасыщенные: олеиновая, линолевая).
Отличаются друг от друга жиры разного происхождения набором жирных кислот.
Подобно углеводам жиры также являются важными источниками энергии для организма. 1г жира при полном окислении дает около 9 ккал энергии, в то время как при полном окислении 1 г углеводов или белков выделяется только около 4 ккал. Однако жиры по сравнению с углеводами труднее окисляются и поэтому используются организмом для получения энергии во вторую очередь.
Липоидыявляются обязательными компонентами всех биологических мембран. В организме человека имеются три класса липоидов: фосфолипиды, гликолипиды и стероиды.
Рибоза
ОН ОН
Аденозин
В упрощенном виде строение АТФ можно отразить схемой:
Аденин—-рибоза— Ф.К. -Ф.К. ~ Ф.К.
При использовании АТФ в качестве источника энергии обычно происходит отщепление путем гидролиза последнего остатка фосфорной кислоты:
АТФ + Н2О -> АДФ + Н3РО4 + Q(энергия)
В физиологических условиях, т. е. при тех условиях, которые имеются в живой клетке (температура, рН, осмотическое давление, концентрация реагирующих веществ и пр.), расщепление моля АТФ (506 г) сопровождается выделением 12 ккал, или 50 кДж* энергии. (1 ккал = 4,18 кДж.)
Главными потребителями энергии АТФ в организме являются:
• реакции синтеза;
• мышечная деятельность;
• транспорт молекул и ионов через мембраны (например, всасывание веществ из кишечника, образование мочи в почках, формирование
и передача нервного импульса и др.).
Таким образом, биологическая роль АТФ заключается в том, что это вещество является универсальным аккумулятором энергии, своего рода энергетической «валютой» клетки.
Основным поставщиком АТФ является тканевое дыхание - завершающий этап катаболизма, протекающий в митохондриях всех клеток, кроме красных клеток крови (эритроцитов).
Полезная информация
В сутки взрослый человек, не выполняющий физической работы, вдыхает и выдыхает 8-10 м3 воздуха, из которого в легких извлекается и используется организмом в обмене веществ 400-500 л кислорода.
В этих же условиях в сутки в процессе обмена веществ образуется и выделяется из организма 350—450 л углекислого газа.
Выполнение физических нагрузок приводит к значительному увеличению потребления кислорода и выделению углекислого газа.
ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
Ферменты, или энзимы, - это особые белки, выполняющие роль катализаторов химических реакций. Практически все химические реакции в организме протекают с огромными скоростями благодаря участию ферментов.
СТРОЕНИЕ ФЕРМЕНТОВ
Участок молекулы фермента, на котором происходит катализ, получил название «активный центр». Если фермент по строению является простым белком, то его активный центр формируется только остатками аминокислот, которые обычно находятся в разных участках одной и той же полипептидной цепи или же в разных полипептидах, но пространственно сближены. Другими словами активный центр образуется на уровне третичной структуры белка-фермента. У ферментов - сложных белков в состав активного центра часто входит их простетическая группа.
Образование активного центра из функциональных групп, довольно далеко отстоящих друг от друга в полипептидных цепях, но совмещенных пространственно в активном центре (т. е. на уровне третичной структуры белка), позволяет ферменту за счет конформационных изменений обеспечивать необходимое соответствие между активным центром и молекулами реагирующих веществ (их обычно называют субстратами). Благодаря изменению конформации фермента происходит как бы «приспособление», «подгонка» активного центра к структуре молекул, превращение которых ускоряется данным ферментом.
Изменение конформации молекулы фермента является также одним из механизмов регуляции скорости ферментативных реакций. В активном центре обычно выделяют два участка - адсорбционный и каталитический.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
В любом катализе, осуществляемом ферментами, можно обнаружить три обязательные стадии.
На первой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному участку активного центра фермента за счет слабых связей. Образуется фермент-субстратный комплекс, который может легко распадаться снова на фермент и субстрат, т. е. первая стадия ферментативного катализа полностью обратима. На этой стадии с помощью активного центра возникает благоприятная ориентация реагирующих молекул, что способствует их дальнейшему взаимодействию.
На второй стадии с участием каталитического участка активного центра и молекул субстрата происходят различные реакции, характеризующиеся низкой величиной энергии активации и поэтому протекающие с большой скоростью. В результате этих реакций в конечном счете образуется либо продукт реакции, либо почти готовый продукт.
На третьей стадии происходит отделение продукта реакции от активного центра с образованием свободного фермента, способного присоединять к себе новые молекулы субстрата. Если на второй стадии был получен почти готовый продукт, то он предварительно превращается в продукт, который затем отделяется от фермента.
Схематично стадии ферментативного катализа можно представить следующим образом:
I стадия II стадия Ш стадия
Е + S à [ E – S ] à E + P
фермент Химически Продукт
преобразованный
фермент-субстратный комплекс,
где (S– субстрат реакции, P - продукт или почти готовый продукт реакции).
В клетках ферменты, катализирующие многостадийные химические процессы, часто объединяются в комплексы, называемые мультиферментными системами. Эти комплексы структурно связаны с органоидами клеток или же встроены в биомембраны. Объединение отдельных ферментов в единый комплекс позволяет одновременно ускорять все последовательные стадии превращения какого-либо субстрата.
В некоторых случаях в катализе наряду с белком-ферментом еще участвует низкомолекулярное (небелковое) соединение, называемое коферментом. Большинство коферментов в своем составе содержат витамины. Строение и механизм действия коферментов будут рассмотрены при описании химических реакций, в которых они принимают участие.
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два вида специфичности ферментов: специфичность действия и субстратную специфичность.
| Глюкоза + Фосфорная кислота (1) Глюкозо-1-фосфат (2) Фруктозо-6-фосфат (3) |
 Специфичность действия - это способность фермента катализировать только строго определенный тип химической реакции. Если субстрат может вступать в разные реакции, то для каждой реакции нужен свой фермент. Например, широко распространенный в клетках глюкозо-6-фосфат (производное глюкозы) подвергается различным превращениям:
Специфичность действия - это способность фермента катализировать только строго определенный тип химической реакции. Если субстрат может вступать в разные реакции, то для каждой реакции нужен свой фермент. Например, широко распространенный в клетках глюкозо-6-фосфат (производное глюкозы) подвергается различным превращениям:
Глюкозо – 6 - фосфат
Отщепление от этого субстрата фосфорной кислоты происходит под действием фермента фосфатазы (1).При этом фосфатаза катализирует только реакцию отщепления фосфорной кислоты, никакие другие превращения глюкозо-6-фосфата этот фермент не ускоряет. Другое возможное превращение глюкозо-6-фосфата осуществляется с участием фермента мутазы (2).В этом случае глюкозо-6-фосфат переходит в глюкозо-1-фосфат. Еще один фермент – изомераза (3)- вызывает превращение глюкозо-6-фосфата во фруктозо-6-фосфат.
Таким образом, каждый фермент катализирует только одну из всех возможных реакций, в которые может вступать субстрат. Специфичность действия определяется в основном особенностями строения каталитического участка активного центра фермента.
Субстратная специфичность- способность фермента действовать только на определенные субстраты.
Различают две разновидности субстратной специфичности: абсолютнуюи относительную.
Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата. На другие вещества, даже очень близкие по строению к этому субстрату, фермент не действует. Примером фермента с абсолютной субстратной специфичностью является аргиназа- фермент, отщепляющий от аминокислоты аргининамочевину. Аргинин - единственный субстрат аргиназы.
Относительная (групповая) субстратная специфичность - это способность фермента катализировать превращения нескольких похожих по строению веществ. Обычно эти вещества обладают одним и тем же типом химической связи и одинаковой структурой одной из химических группировок, соединенных этой связью. Например, фермент пепсинрасщепляет пептидные связи в белках любого строения.
Субстратная специфичность обусловлена главным образом структурой адсорбционного участка активного центра фермента.
ИЗОФЕРМЕНТЫ
Изоферменты (изоэнзимы) - различные молекулярные формы фермента, катализирующие одну и ту же химическую реакцию. Обычно между изоферментами одного и того же фермента имеются различия
Впервичной структуре, т. е. у изоферментов может быть различный набор и последовательность аминокислот в пол и пептидной цепи. Но эти различия, как правило, не затрагивают структуру каталитического участка активного центра, и поэтому изоферменты одного и того же фермента ускоряют одну и ту же химическую реакцию. Различия в аминокислотном составе молекул изоферментов вне каталитического участка приводят к изменениям их физико-химических свойств и субстратной специфичности.
Амилаза слюны - 6,8-7,0
щелочная фосфатаза плазмы крови - 9,0-10,0
Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформа-ция всей белковой молекулы фермента, в том числе изменяется кон-формация активного центра и его способность осуществлять катализ.
 |
|
 V
V 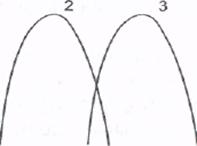

рН 1,5 7,0
Рис. Зависимость скорости ферментативной реакции от рН
(1 - пепсин, 2 - амилаза, 3 - щелочная фосфатаза)
При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значительном отклонении от рН-оптимума (в сильнокислой и сильнощелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности.
При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов.
Ингибиторы ферментов
Скорость ферментативной реакции существенно зависит от присутствия ингибиторов и активаторов.
Ингибиторы(I) - это химические соединения (обычно низкомолекулярные), которые, находясь в низких концентрациях, избирательно тормозят определенные ферментативные реакции. При этом ингибитор всегда присоединяется к ферменту с образованием фермент-ингибиторного комплекса. Фермент, связанный с ингибитором, теряет свою каталитическую активность.
Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает во времени вплоть до полного прекращения ферментативной реакции:
Е + I à Е 1
Такие ингибиторы называются необратимыми.Примером необратимых ингибиторов являются фосфорорганические соединения (табун, зарин, дихлофос, карбофос и др.), избирательно и необратимо угнетающие важнейший фермент организма холинэстеразу, участвующую в передаче нервных импульсов.
Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не зависит от времени:
|
Ингибиторы такого типа называются обратимыми.
В свою очередь, обратимые ингибиторы делятся на две разновидности: конкурентные и неконкурентные.
Конкурентные ингибиторы присоединяются к активному центру фермента, т. е. к тому же участку поверхности фермента, что и субстрат. Поэтому между ингибитором и субстратом идет конкуренция за присоединение к активному центру. Занимая активный центр, ингибитор тем самым препятствует образованию фермент-субстратного комплекса - первой стадии ферментативного катализа. Конкурентные ингибиторы обычно по строению похожи на субстрат.
Неконкурентные ингибиторы присоединяются к ферменту вне активного центра. Этот участок поверхности фермента называется алло-стерический центр(т. е. находящийся в другом месте по сравнению с активным центром).
Присоединение неконкурентного ингибитора к аллостерическому центру вызывает неблагоприятное изменение пространственной структуры (конформации) всей молекулы фермента, в том числе и активного центра. В результате каталитические свойства фермента снижаются.
Неконкурентные ингибиторы участвуют в регуляции скорости ферментативных реакций, протекающих в организме. В роли неконкурентных ингибиторов могут быть гормоны, конечные и промежуточные продукты ферментативных реакций, ионы металлов, лекарственные вещества.
Активаторы ферментов
Активаторы- вещества, избирательно повышающие скорость определенных ферментативных реакций. Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к аллостерическому центру фермента. Но в этом случае изменение конформации фермента будет благоприятным для функционирования активного центра, что приводит в итоге к повышению скорости ферментативной реакции. В организме активаторами являются некоторые гормоны, промежуточные продукты метаболических процессов, ионы металлов, а также лекарственные препараты.
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Как уже отмечалось, в процессе обмена веществ в организме происходят различные реакции окисления, которые объединяют термином биологическое окисление.
Основным типом биологического окисления является тканевое дыхание, протекающее в клеточных митохондриях (в связи с этим тканевое дыхание еще называется митохондриальным окислением).
ТКАНЕВОЕ ДЫХАНИЕ
Тканевое дыхание - это основной способ получения АТФ, используемый всеми клетками организма (кроме красных клеток крови).
В процессе тканевого дыхания от окисляемого вещества отнимаются два атома водорода (два протона и два электрона) и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород - О2) доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов водорода к кислороду образуется вода. За счет энергии, выделяющейся при движении электронов по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. Обычно образование одной молекулы воды сопровождается синтезом трех молекул АТФ.
В упрощенном виде тканевое дыхание может быть представлено следующей схемой:
АН2 + 1/2 О2 à А + Н2О
| Окисленное вещество |
Окисляемое вещество
 |
3 АДФ + 3 Н3РО4 à ЗАТФ
В качестве субстратов окисления (т. е. веществ, от кот
