В окислительно – восстановительной реакции
Fe3+ + 3e=Fe°
один ион Fe3+ реагирует с тремя электронами и поэтому: Э( 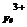 ) = l/3Fe3+
) = l/3Fe3+
В реакции Fe3+ + е = Fe2+ Э( 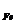
 ) = Fe3+
) = Fe3+
Таким образом, зная суммарное уравнение кислотно-основной, ионообменной или окислительно-восстановительной реакции, можно установить химическую формулу эквивалента вещества, участвующего в реакции. Количество вещества измеряют в молях.
Моль - количество вещества, содержащего 6,02´1023 структурных элементов: атомов, молекул, ионов, эквивалентов. Таким образом, моль эквивалентов – количество вещества, содержащего 6,02´1023 эквивалентов. Масса моля эквивалентов называется молярной массой эквивалента Мэ, г/моль.
Молярные массы эквивалентов рассчитываются по формулам:
1) для простого вещества 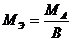 ;
;
2) для сложного вещества 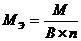 ,
,
где: М – молярная масса данного вещества; В – валентность функциональной группы; n – число функциональных групп в молекуле.
Для кислот функциональной группой является ион водорода, для гидроксидов – ион гидроксида, для солей – ион металла. Например:
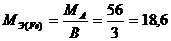 г/моль;
г/моль;
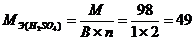 г/моль;
г/моль;
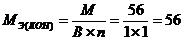 г/моль;
г/моль;
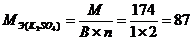 г/моль
г/моль
3) для расчета величины моля эквивалента вещества в окислительно – восстановительных реакциях применяют формулу расчета 1), но где В – это число электронов, участвующих в реакции.
Например, для реакции Fe3+ + 3e=Fe°
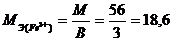 г/моль
г/моль
Для газообразных веществ пользуются величинами объема моля эквивалента. Например, в реакции окисления водорода
Н2 – 2е = 2Н+
Эквивалент газообразного водорода - это половина его молекулы
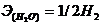 ,
,
поэтому один моль эквивалентов водорода занимает при нормальных условиях объем
22,4 : 2= 11,2 л.
Аналогично рассчитывается 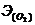
О2 + 4е = 20-, т .е 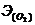 =22,4л :4 = 5,6 л
=22,4л :4 = 5,6 л
Раствор, содержащий один моль эквивалентов вещества в 1 дм3, называется нормальным и обозначается 1 N или 1 Н.
Закон эквивалентов: все вещества реагируют, друг с другом в эквивалентных количествах. Массы веществ, участвующих в реакциях пропорциональны молярным массам их эквивалентов:
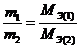 и как следствие,
и как следствие, 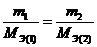 ,
,
т.е. количества молей эквивалентов участвующих в реакции веществ равны между собой.
Закон эквивалентов для реакции мА + пВ = АмВм, протекающей в растворе, можно записать следующим образом:
VANA = VBNB,,
где: VA и vВ – объемы реагирующих растворов; nА и nВ – нормальные концентрации этих растворов.
Опыт 1. Определение молярной массы эквивалента металла (Mg, A1 или Zn) методом вытеснения водорода.
Метод основан на измерении объема водорода, который, выделяется из кислоты при действии на нее металла.
Применяемый для этой цели прибор состоит из двух бюреток, укрепленных на штативе и соединенных резиновой трубкой. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Одну из бюреток сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку, где происходит реакция между кислотой и металлом. Другая бюретка служит приемником для воды, вытесняемой выделяющимся при реакции водородом.
Объем выделившегося водорода определяют по разности уровней воды в любой из бюреток до и после опыта при давлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в обеих бюретках находится на одном уровне.
Даже при комнатной температуре пар над поверхностью воды обладает заметным давлением. Это следует учитывать при вычислении объема газа, собранного над водой. Поэтому для определения парциального давления водорода необходимо от общего (атмосферного) давления, под которым находится водород, вычесть давление насыщенного водяного пара h (табл.):
РН 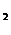 = Ратм - h
= Ратм - h
Для приведения объема выделившегося водорода к нормальным условиям используют уравнение газового состояния:
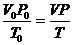 ,
,
где: vо – объем выделившегося водорода при н.у., мл; Р0 – парциальное давление водорода при н.у., равное 101,3 кПа (760 мм рт. ст.); Т0 - температура, 273 K;V – объем выделившегося водорода при условиях опыта, мл; Р – парциальное давление водорода при данных условиях, к Па (мм рт. ст.); Т – температура опыта, К.
Таблица.
Давление насыщенного пара.
Определив объем водорода при н.у., вычисляют массу 1 моля эквивалента металла:
m г металла вытесняют V0 мл водорода
х г металла вытесняют 11200мл. водорода
Выполнение опыта
Получите навеску металла у лаборанта. В пробирку налейте соляной кислоты (на одну четверть пробирки); поддерживая пробирку в наклонном положении, поместите навеску металла (не опуская в кислоту) на стенку у отверстия пробирки и закройте пробирку пробкой с отводной трубкой от бюретки.
Проверьте герметичность прибора. Для этого, не трогая бюретку с пробиркой, переместите другую бюретку вместе с лапкой штатива так, чтобы уровень воды в ней стал на 5-10 см выше, чем в первой бюретке. Если разница в уровнях не изменяется, прибор исправен, "держит"; если уровни в бюретках выравниваются, прибор негерметичен, пропускает воздух, о чем следует заявить лаборанту.
Приведите воду в бюретках к одному уровню и отметьте уровень воды в открытой бюретке. Наблюдение производить по нижнему мениску жидкости с точностью до 0,1.
Стряхните металл в кислоту (смойте его кислотой). Наблюдайте выделение водорода и вытеснение воды из бюретки.
По окончании реакции дайте пробирке охладиться на воздухе, после чего снова приведите воду н бюретках к одному уровню. Запишите новый уровень воды в бюретке. По парности уровней воды до и после реакции рассчитайте объем выделившегося водорода.
По данным опыта определите молярную массу эквивалента металла. Сравнивая ее с теоретическим значением молярной массы эквивалента металла (Mg. Al, Zn) определите какой металл был взят для реакции.
Запишите в журнал:
1.навеску металла, г;
2…...уровень воды в бюретке до реакции, мл;
3.yровень воды в бюретке после реакции, мл;
4.температура, К;
5.атмосферное давление, кПа (мм рт. ст.);
6.давление насыщенного водяного пара, кПа (мм рт. ст.);
7.давление водорода, кПа (мм рт. ст.).
По полученным данным рассчитайте:
1.объем выделившегося водорода;
2.объем водорода при нормальных условиях;
3.теоретическую молярную массу эквивалента Mg, Al, Zn;
4.опытную молярную массу эквивалента металла;
5.ошибки опыта:
а) абсолютную Dе=Мэ(теор) - МЭ(опытн)
б) относительную 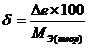 , %
, %
Запишите уравнение реакции взаимодействия металла с соляной кислотой.
